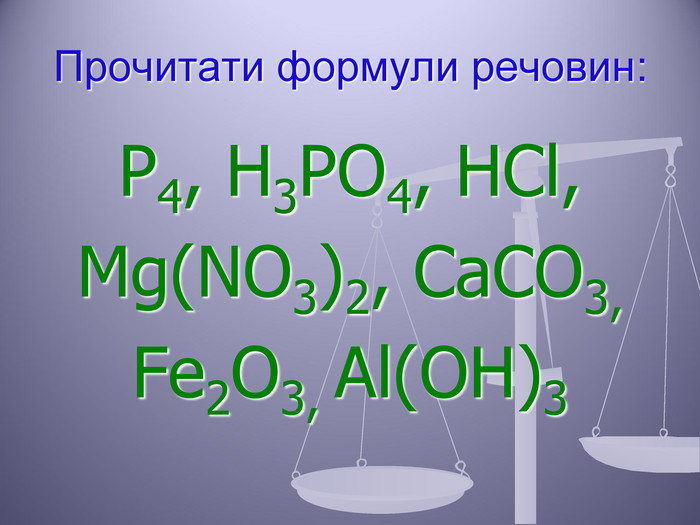
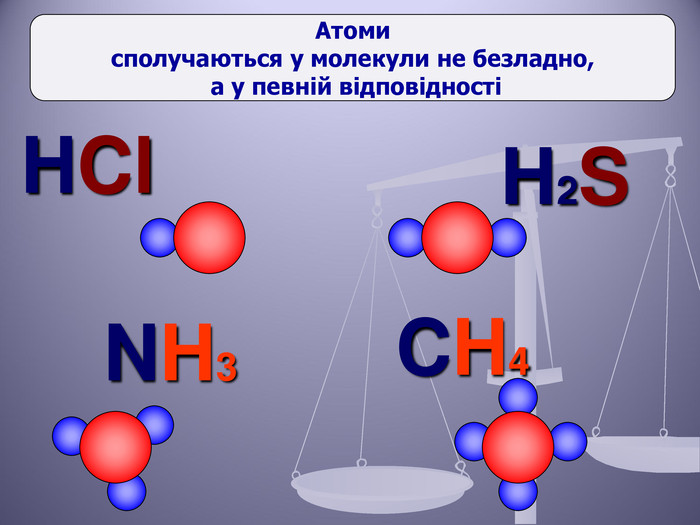
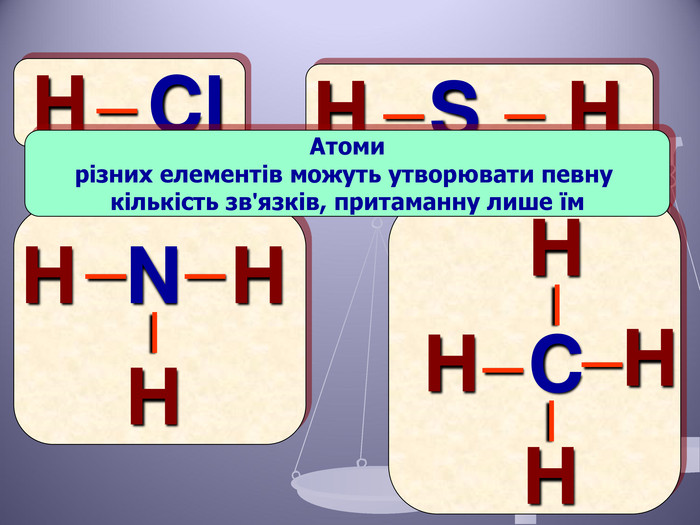
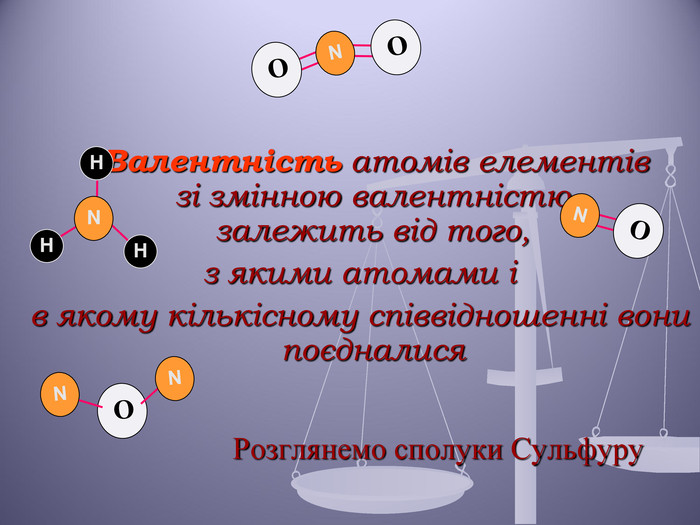
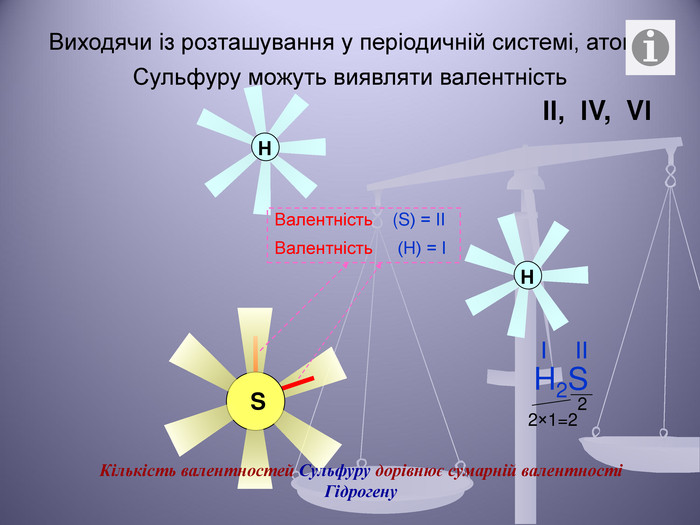
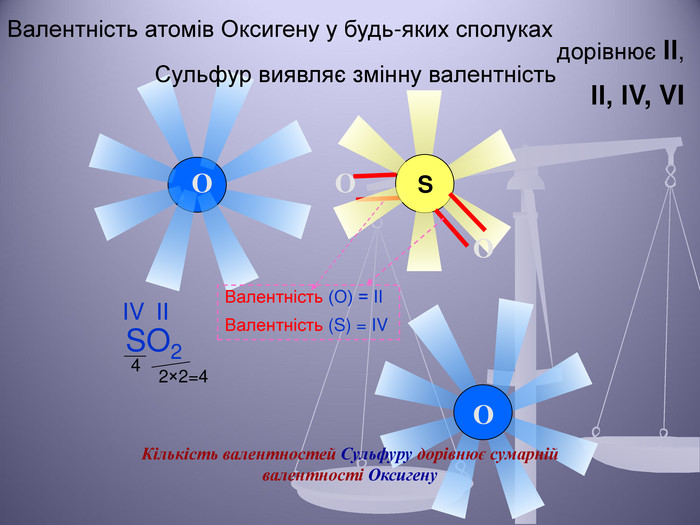
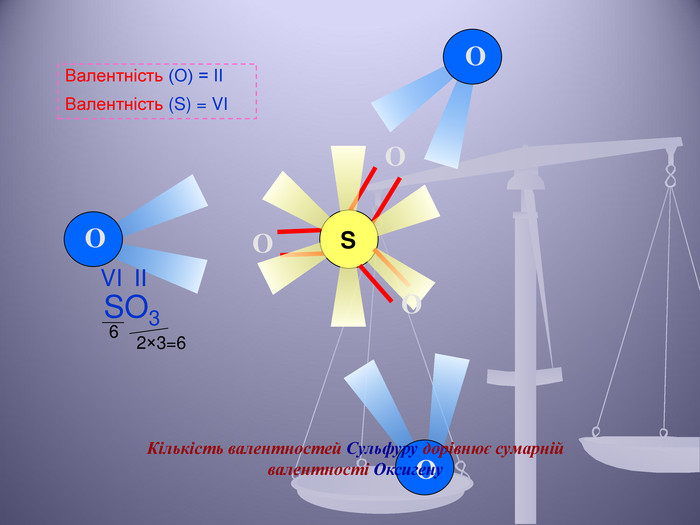
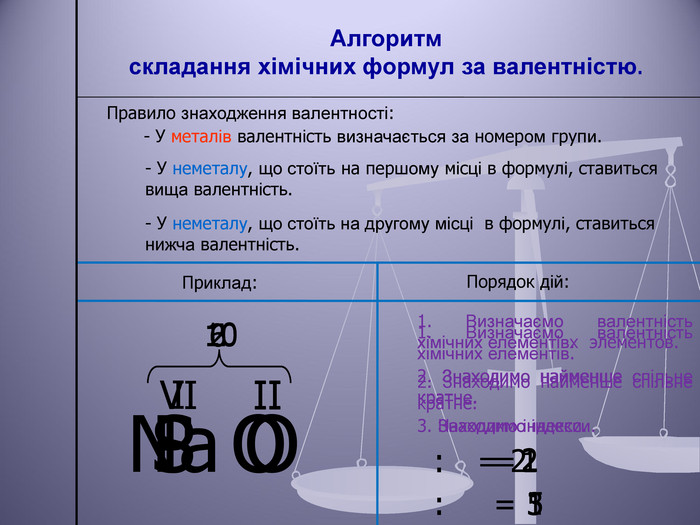
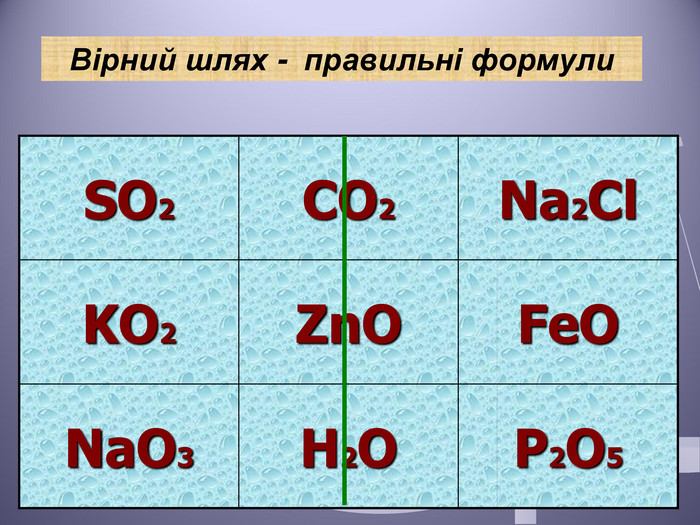
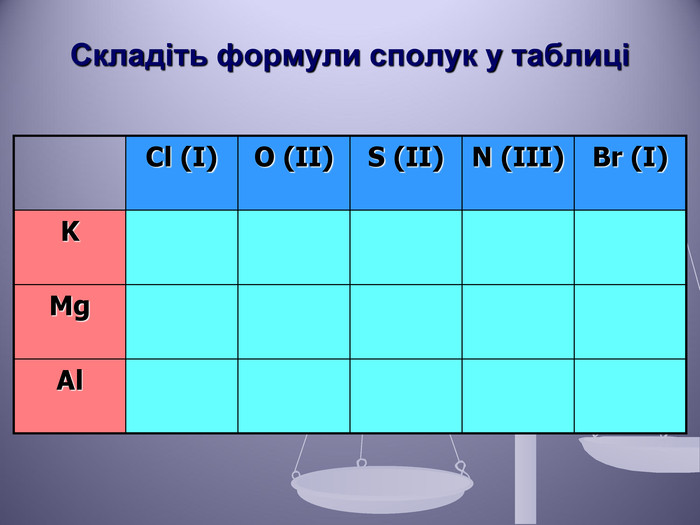
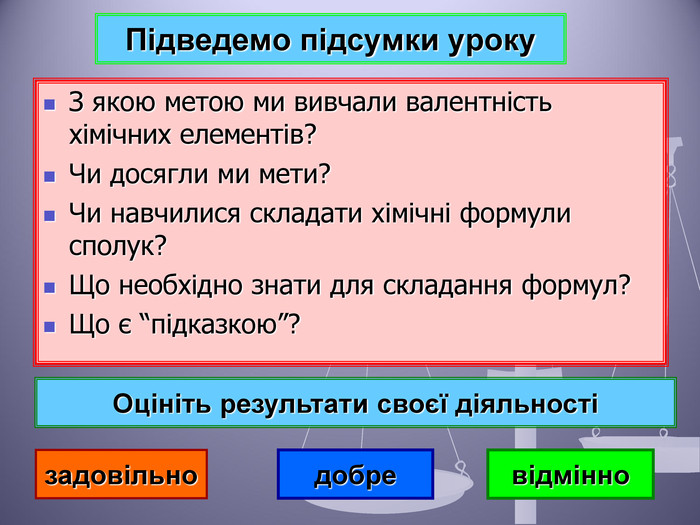
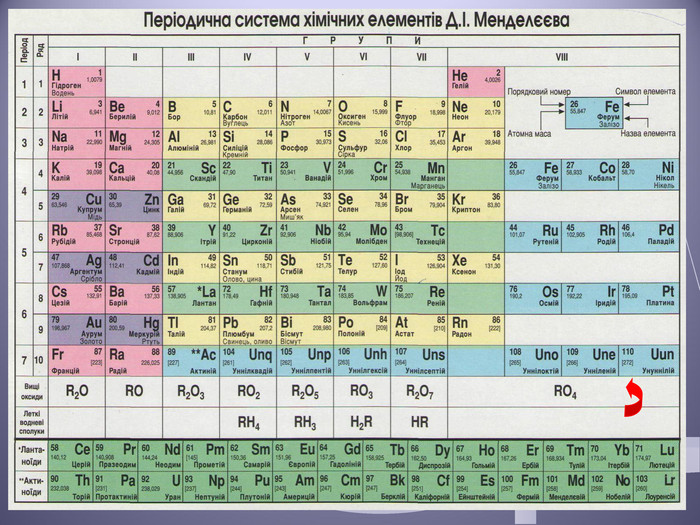
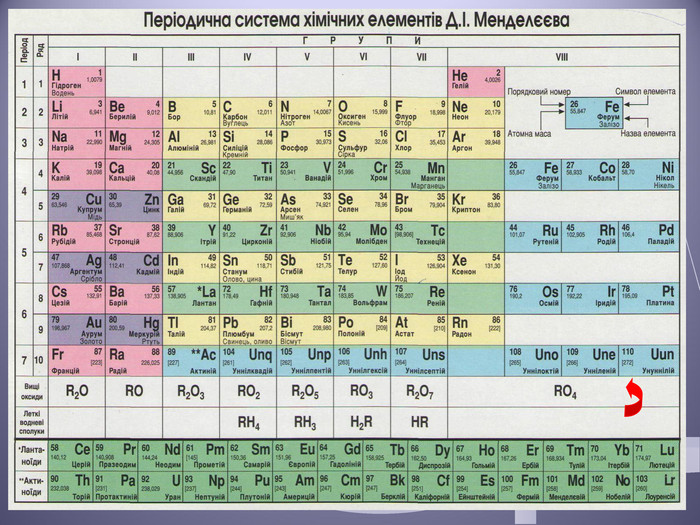
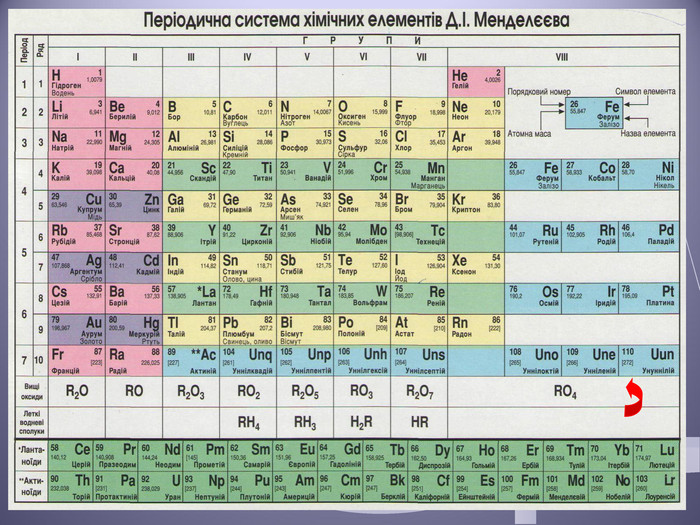
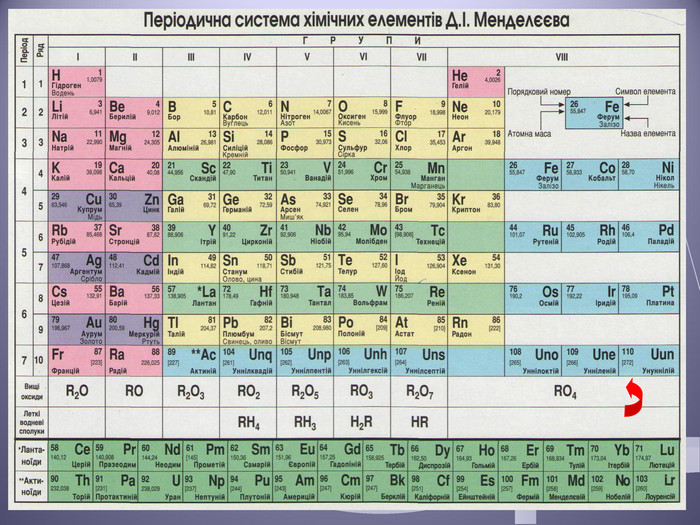
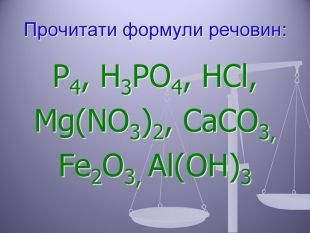
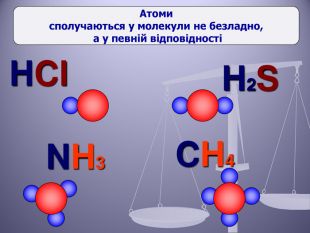
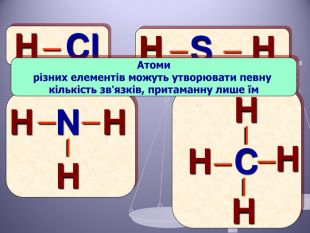
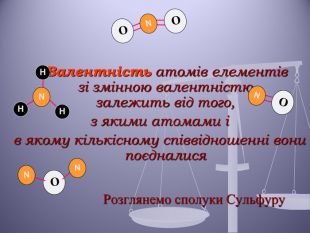
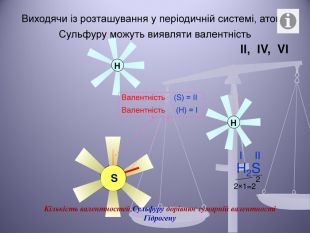
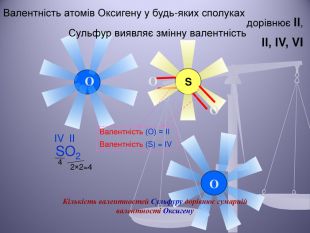
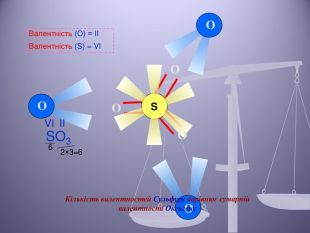
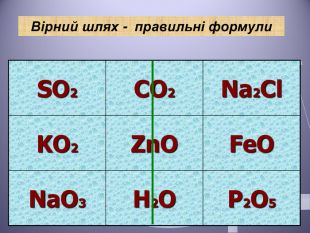
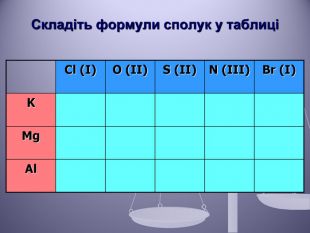
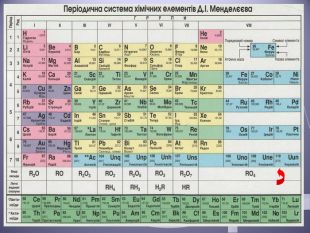
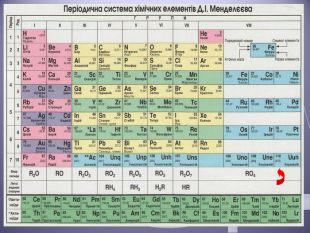
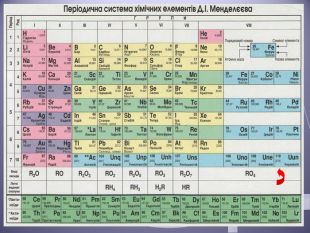
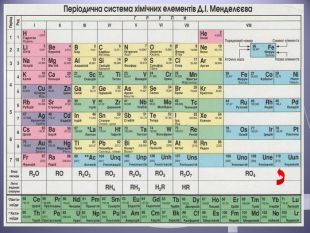
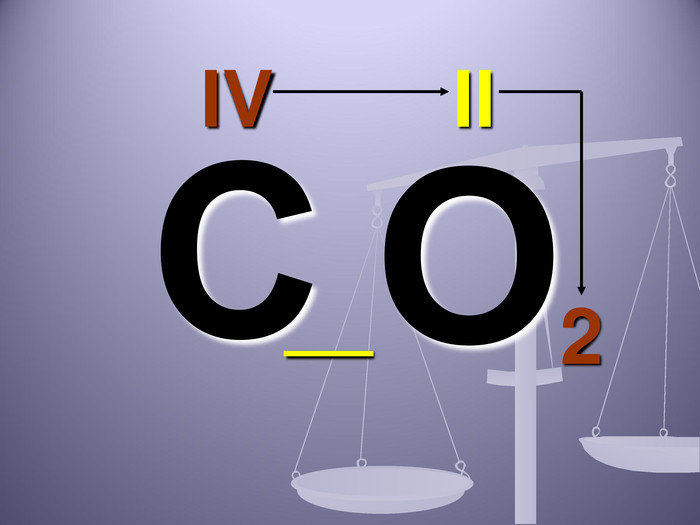Презентація до уроку "Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів."
Про матеріал
Презентація до уроку "Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів."
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку