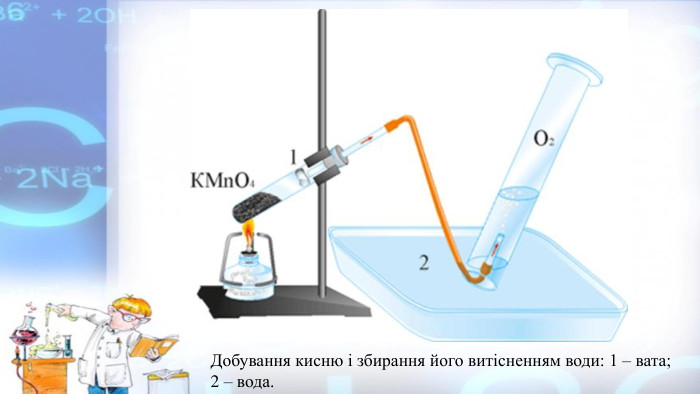
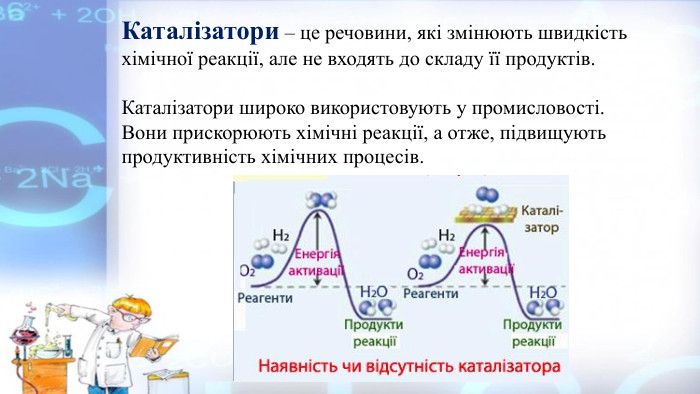
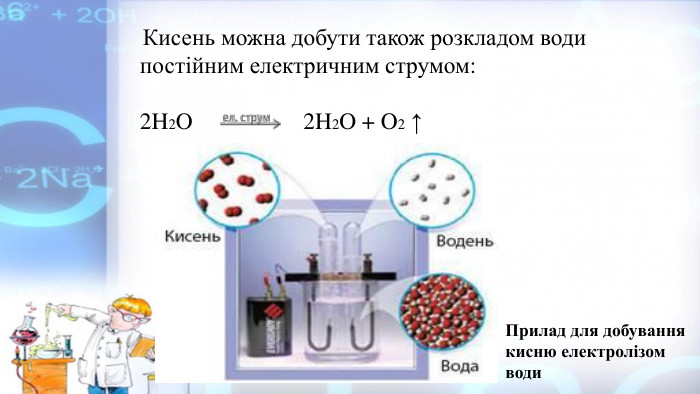
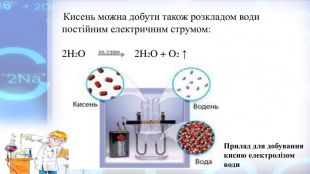
Презентація "Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню"
Про матеріал
Презентація "Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню" стане в нагоді при проведенні уроків хімії в 7 класі, при самостійному вивченні цієї теми. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
Дякую)


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку