Презентація " Гальванічний елемент"



























Мета уроку: Навчальна: розширити та поглибити знання про гальванічний елемент, як хімічне джерело електричного струму; систематизувати та узагальнити знання щодо протікання струму в різних середовищах; показати практичну значущість набутих знань у побуті, техніці, на виробництві. Розвиваюча: сприяти збагаченню словникового запасу; формуванню пізнавальної самостійності; розвитку спостережливості, уваги, пам’яті, уяви, мислення; . Виховна:виховувати уважність, зібраність, спостережливість.
Фізичні джерела До фізичних джерел електричного струму прийнято відносити пристрої, в яких розділення зарядів відбувається за рахунок механічної, світлової або теплової енергії. Прикладами таких джерел струму можуть бути електрофорна машина , турбогенератори електростанцій, фото- і термоелементи тощо. Турбогенератор електростанціїЕлектрофорна машина
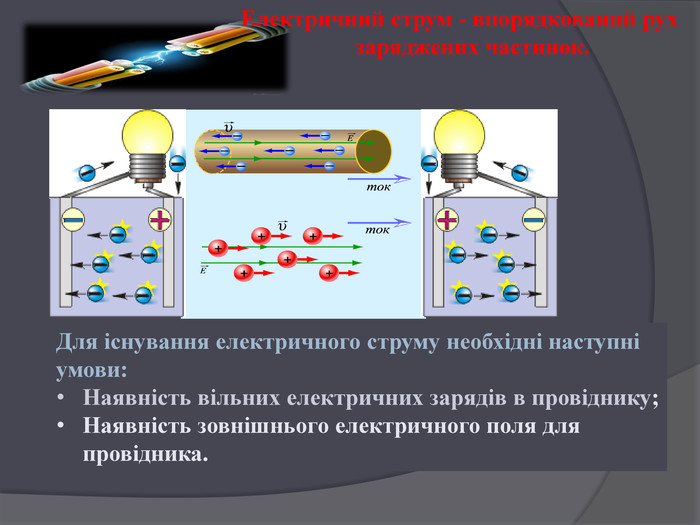
Хімічні джерела. Незважаючи на всю різноманітність фізичних джерел електричного струму, у повсякденному житті ми здебільшого маємо справу з хімічними джерелами електричного струму - гальванічними елементами й акумуляторами. Хімічними джерелами елктричного струму називають пристрої, в яких розподіл зарядів відбувається за рахунок енергії, що виділяється внаслідок хімічних реакцій.
Історичні відомостіЯвище виникнення електричного струму при контакті різних металів було відкрито італійським фізіологом, професором медицини Болонського університету Луїджі Гальвані у 1786 році. Гальвані описав скорочення м'язів задніх лапок жаби, закріплених на мідних гачках, при дотику сталевого скальпеля. Спостереження були пояснені першовідкривачем як прояв «тваринної електрики».
У 1836 році англійський хімік Джон Фредерик Даніель та незалежно від нього німецький і російський фізик-винахідник Б. С. Якобі, запропонували інший елемент. Cu2+ + Zn = Сu + Zn2+Zn|Zn2+||Cu2+|Cu. Джон Фредерик Даніель Якобі Борис Семенович. Подвійний електричний шар. 1 – металічна пластина 2- розчин
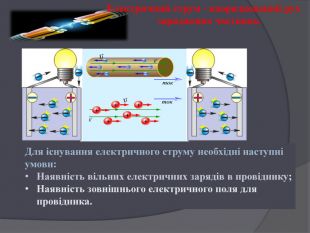
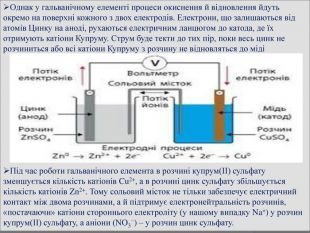
Принцип дії гальванічного елемента. Гальванічний елемент Даніеля-Якобі складається з двох посудин. В одній міститься розчин цинк сульфату, у який занурено пластинку з цинку, в іншій – купрум(ІІ) сульфату у який занурено пластинку з міді. Розчини з’єднано трубкою (сольовим містком), що заповнена розчином електроліту, йони якого ʜе взаємодіють з іншими йонами в гальванічному елементі, наприклад натрій нітрату. У такий спосіб забезпечується електричний контакт між посудинами. Для того щоб розчин не виливався, кінці трубки закривають скловатою чи гелем, просоченим електролітом. Якщо електроди з’єднати дротинками з електричною лампочкою, то вона засвітиться. Через деякий час в обох склянках можна спостерігати хімічні перетворення: цинкова пластинка розчиняється, а на мідній пластинці з розчину осаджується мідь. Розмір цинкової пластинки зменшується, а мідної – збільшується. Водночас послаблюється забарвлення розчину купрум(ІІ) сульфату (концентрація йонів Сu2+ знижується). Ці хімічні зміни є результатом перенесення електронів з однієї частини елемента до іншого, тобто це типовий електрохімічний процес. .
У гальванічному елементі відбувається типовий електрохімічний процес, що пояснюється окисно-відновними реакціями. Атоми цинку, утрачаючи електрони, окиснюються й перетворюються на катіони Цинку: Zn – 2ē = Zn2+. На цинковому електроді концентруються електрони, тому він набуває негативного заряду. Цинковий електрод називають анодом. На поверхні мідної пластини електрони захоплюються катіонами Купруму з розчину, відновлюючи їх до атомів міді, які й осідають на пластині. Відбувається процес відновлення: Сu2+ + 2ē = Сu. Мідний електрод унаслідок відновлення набуває позитивного заряду; такий електрод дістав назву катод. Сумарне рівняння окисно-відновного перетворення в гальванічному елементі: Cu2+ + Zn = Сu + Zn2+.
Однак у гальванічному елементі процеси окиснення й відновлення йдуть окремо на поверхні кожного з двох електродів. Електрони, що залишаються від атомів Цинку на аноді, рухаються електричним ланцюгом до катода, де їx отримують катіони Купруму. Струм буде текти до тих пір, поки весь цинк не розчиниться або всі катіони Купруму з розчину не відновляться до мідіПід час роботи гальванічного елемента в розчині купрум(ІІ) сульфату зменшується кількість катіонів Cu2+, а в розчині цинк сульфату збільшується кількість катіонів Zn2+. Тому сольовий місток не тільки забезпечує електричний контакт між двома розчинами, а й підтримує електронейтральність розчинів, «постачаючи» катіони стороннього електроліту (у нашому випадку Na+) у розчин купрум(ІІ) сульфату, а аніони (NO3−) – у розчин цинк сульфату.
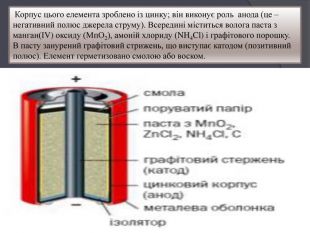
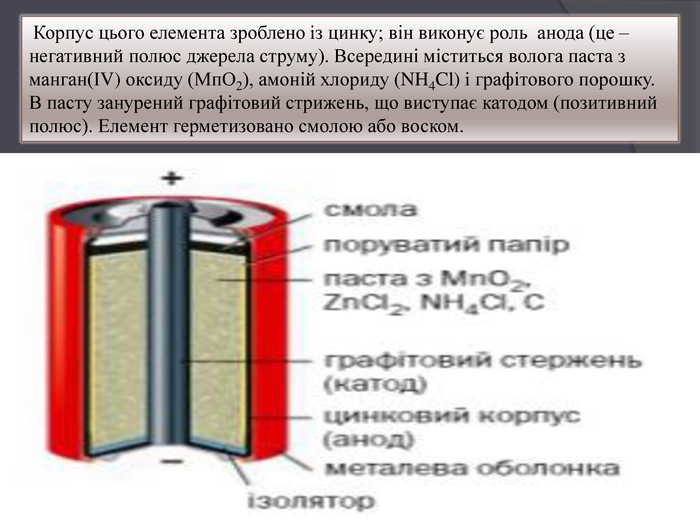
Корпус цього елемента зроблено iз цинку; він виконує роль анода (це – негативний полюс джерела струму). Всередині міститься волога паста з манган(ІV) оксиду (Мп. О2), амоній хлориду (NH4 Cl) i графітового порошку. В пасту занурений графітовий стрижень, що виступає катодом (позитивний полюс). Елемент герметизовано смолою або воском.
Під час роботи елемента відбуваються такі процеси: Цинк зазнає окиснення: Zn − 2ē = Zn2+. Через це корпус елемента iз середини поступово руйнуться. На графітовому катоді відновлюється Манган: Мn+4 + ē =Мn+3. Протікає хімічна реакція, що описується рівнянням : Zn + 2 Mn. O2 + 2 NH4 Cl = 2 Mn. O(OH) + Zn. Cl2 + 2 NH3 На полюсах елемента створюється напруга в 1,5 В.
Існують хімічні джерела струму, які періодично заряджають від електричної мережі й використовують знову. Це акумулятори. В акумуляторі речовини, що витрачаються під час споживання струму,акумулюються на електродах. Тому його можна повернути в первісний стан,якщо ззовні крізь нього пропустити електричний струм. Свинцевий акумулятор – ЕРС = 2 ВPb. O₂ +Pb + 2 H₂SO₄ ↔ 2 Pb. SO₄ + 2 H₂O
Різновиди гальванічних елементів. Сучасні гальванічні елементи: а - звичайні гальванічні елементи; б — акумуляторна батарея; в —батарея гальванічних елементів. Батарейка для годинника (збільшено)а — елемент Лекланше (батарейка); б — ртутна батарейка; в — кислотний свинцевий акумулятор
Айса Міжено та її винахід. SALt (Sustainable Alternative Lighting) - лампа, яка може горіти протягом 8 годин на одній склянці води і двох чайних ложках солі. Волонтер Грінпіс і за сумісництвом інженерка університету De La Salle Айса Міжено (Aisa Mijeno) прийшла до ідеї створення «соляного світильника» під час перебування в місцевих філіппінських племенах. Це світлодіодна лампа, джерелом енергії для якої є гальванічний елемент. За словами винахідниці, готовий продукт - сольова батарея - не тільки забезпечить світлом будинки без центральної електромережі, а й дасть змогу заряджати мобільні пристрої (смартфони, планшети) через USB-порт, убудований у бічну частину лампи.
Використаєм здобуті знання на практиціЛимонний та картопляний гальванічний елемент. Обережно почавіть лимон / карторлю, щоб не здерти шкірку, та зробіть два невеликі розрізи на його протилежних боках. У розрізи вставте цинкову та свинцеву пластинки, з'єднайте їх із вольтметром і визначте показники . Повторіть дослід, використовуючи інші наявні металеві пластини (стрижні або фольгу) в різних комбінаціях. Поясніть отримані результати. Для точніших вимірювань замість одного лимона можна використати низку послідовно з'єднаних лимонних гальванічних елементів. Замість лимона можна використати апельсин або інші фрукти та овочі. Дослідіть, чи залежать показники вольтметра від використаного фрукта. Пам'ятайте! Після дослідів використані фрукти їсти не можна!
Працювавши над проектом учні 11 класу досліджували роботу лимонного та картопляного гальванічних елементів як хімічне джерело живлення. Щоб зрозуміти, що напруга з картоплі - це не вигадка, а цілком реальна річ, досить увімкнути в картоплину металеві пластини й під'єднати до електронного годинника. І він запрацює. Чому картопля та лимон є гальванічними елементами? Сік картоплі містить розчинені солі та кислоти, які є, по суті, природним електролітом. Таким чином, картопля й лимон можуть живити не тільки людину, але й електроприлади. Усередині них через окиснення з зануреного анода (оцинкований контакт) витікатимуть електрони, які будуть притягуватися до мідного контакту. Електрика не утворюється з картоплі чи лимона, а саме завдяки хімічним процесам між трьома елементами: цинком, міддю, кислотою.
ВИСНОВКИПристрої, які виробляють електричний струм завдяки перебігу в них окисно-відновних реакцій, називають хімічними джерелами струму. До них належать гальванічні елементи. Головними їхніми складниками є активний метал, який виступає відновником, і деякі сполуки-окисники. Гальванічний елемент є основою батарейки. Інший вид хімічного джерела струму — акумулятор. Завдяки перебігу оборотної окисно-відновної реакції його можна багаторазово заряджати. Зростаюче використання хімічних джерел струму потребує налагодження сфери їх утилізації.
Опрацюйте §13. Запропонуйте гальванічний елемент подібний Даніелу, в одному з яких нікелевий електрод буде катодом, а інший анодом. Запишіть процеси, які відбуваються на електродах. Визначте, яким може бути склад гальванічного елемента (матеріал електродів та склад електролітів), у якому відбуваються процеси:на аноді: Ni0 + 2 OH- - 2e- → Ni(OH)2;на катоді: Ni(OH)3+ e- → Ni(OH)2+ OH-. Складіть сумарне молекулярне рівняння хімічної реакції в цьому елементі. Розробіть сценарій заходу, спрямованого на формування культури використання батарейок для: а) молодшого учнівства; б) мешканців і мешканок вашого будинку. Домашнє завдання


про публікацію авторської розробки
Додати розробку