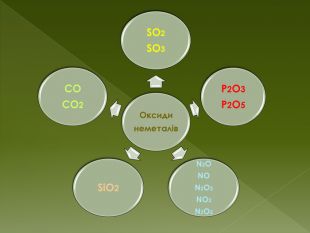
Презентація до уроку на тему " Оксиди неметалів"
В презентації викладені основні властивості, будова та застосування оксидів неметалів.





































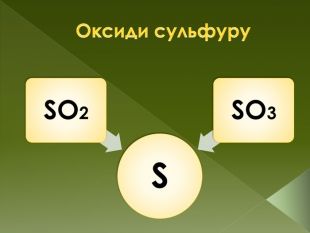
Застосування. SO2 Велика частина оксиду сірки (IV ) використовується для виробництва сірчаної кислоти. Використовується також у виноробстві як консервант (харчова добавка E220 ) . Так як цей газ вбиває мікроорганізми , їм обкурюють овочесховища і склади . Оксид сірки (IV ) використовується для відбілювання соломи , шовку і вовни , тобто матеріалів , які не можна вибілювати хлором. Застосовується він також і як розчинник в лабораторіях. SO3 У виробництві сульфатної кислотиstyle.font. Stylestyle.font. Weightstyle.text. Decoration. Underline
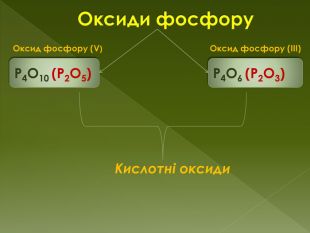
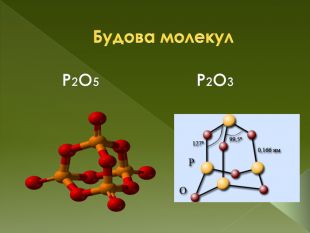
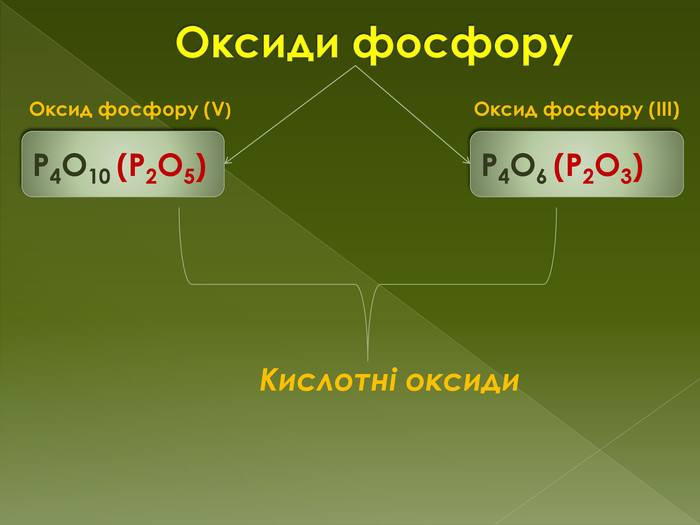
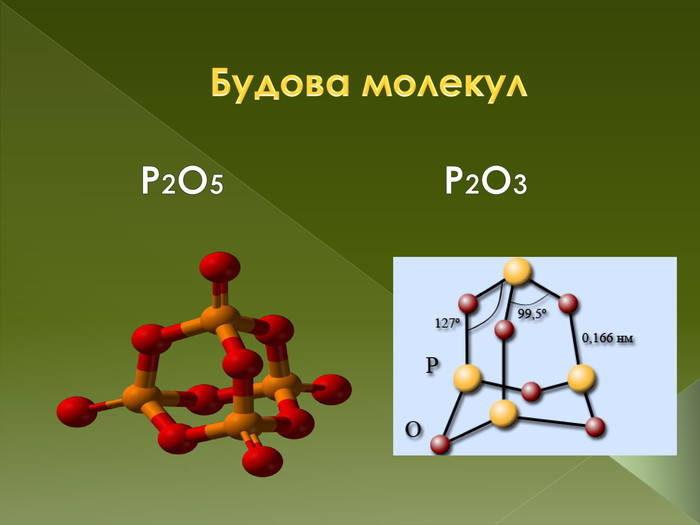
фізичні властивостіОксид фосфору (III) - білий пухкий кристалічний порошок з неприємним запахом, легко переганяється, температура плавлення 24 ° С, температура кипіння 174 ° С. Добре розчинний в органічних розчинниках. Дуже отруйний. Оксид фосфору (V)-безбарвна аморфна або склоподібна речовина, існує у трьох кристалічних, двох аморфних і двох рідких формах. Токсична речовина. Викликає опіки шкіри і роздратування слизової оболонки.
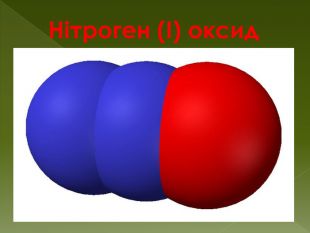
N2 O - нітроген (I) оксид«звеселяючий газ» - створює сміхотворний ефект. Фізичні властивостіБезбарвний газ, важчий за повітря, з характерним солодкуватим запахом і смаком. Розчинний у воді. При 0 ° C і тиску 30 атм, а також при кімнатній температурі і тиску 40 атм згущується в безбарвну рідину. З 1 кг рідкого закису азоту утворюється 500 л газу. Не запалюється, але підтримує горіння. Хімічні властивостіНесолетвірний оксид. За нормальних умов N2 O хімічно інертний, при нагріванні проявляє властивості окиснювача: N2 O + H2 → N2↑ + H2 OПри взаємодії з сильними окиснювачами може проявляти властивості відновника: При нагріванні розкладається на азот і кисень
NO - нітроген (II) оксид. Фізичні властивостібезбарвний газ, погано розчинний у воді. Зріджується важко; в рідкому і твердому вигляді має блакитний колір. Хімічні властивостіНесолетвірний оксид. За нормальних умов окиснення NO киснем повітря відбувається миттєво:2 NO + O2 → 2 NO2 Для NO характерні також реакції приєднання галогенів з утворенням нітрозілгалогенідов, у цій реакції NO проявляє властивості відновлювача:2 NO + Cl2 → 2 NOCl (нитрозілхлорид)В присутності більш сильних відновлювачів NO проявляє окиснювальні властивості2 SO2 + 2 NO → 2 SO3 + N2↑
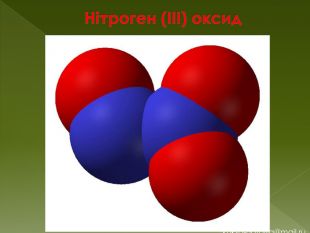
N2 O3 - нітроген (III) оксид. Фізичні властивостіN2 O3 - безбарвний газ (за н. у.). В твердому вигляді - синюватого кольору. Стійкий тільки при температурах нижче -101°C. Без домішок N2 O3 існує тільки в твердому виглядіХімічні властивостіКислотний оксид. N2 O3 схильний до термічної дисоціації: N2 O3↔ NO2 + NO Будучи азотистим ангідридом, при взаємодії з водою N2 O3 дає нітритну кислоту: N2 O3 + H2 O ↔ 2 HNO2 При взаємодії з розчинами лугів утворюються відповідні нітрити. N2 O3+2 KOH→2 KNO2+ H2 O.
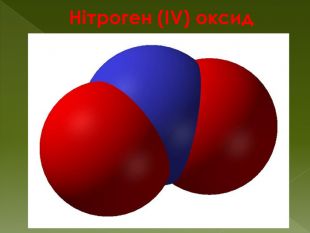
NO2 - Нітроген (IV) оксид. Фізичні властивості Газ, червоно-бурого кольору, з характерним гострим запахом. Хімічні властивостіКислотний оксид, йому відповідають азотна і азотиста кислоти. NO2 відрізняється високою хімічною активністю. Він взаємодіє з неметалами (як окисник): 2 NO2 + 2 C → 2 CO2↑ + N2↑При розчиненні оксиду азоту (IV) у воді утворюються азотна і азотиста кислоти (реакція диспропорціонування):2 NO2 + H2 O ↔ HNO3 + HNO2 Оскільки азотиста кислота нестійка, при розчиненні NO2 в теплій воді утворюються HNO3 та NO:3 NO2 + H2 O → 2 HNO3 + NO↑Якщо розчинення проводити в надлишку кисню, утворюється тільки азотна кислота.
N2 O5 - Нітроген (V) оксид N2 O5 - безбарвні, дуже леткі кристали. Дуже нестійкий. Фізичні властивостіГазоподібний азотний ангідрид складається з окремих молекул, будова яких відповідає формулі O2 N-О-NO2. Кристали утворені йонами NO21- і NO31-. Хімічні властивостіТиповий кислотний оксид. N2 O5 легко летючих і вкрай нестійкий. Розкладання відбувається з вибухом, найчастіше - без видимих причин:2 N2 O5 → 4 NO2↑ + O2↑ + Q. Розчиняється у воді з утворенням азотної кислоти (оборотна реакція): N2 O5 + H2 O ↔ 2 HNO3. Розчиняється в лугах з утворенням нітратів: N2 O5 + 2 Na. OH → 2 Na. NO3 + H2 O
Фізіологічна дія та застосування оксидів нітрогену. N2 O – використовується як засіб для інгаляційного наркозу в основному в поєднанні з іншими препаратами. Цю сполуку можна назвати найбезпечнішим засобом для наркозу, тому що після його застосування майже не буває ускладнень. Також іноді використовується для поліпшення технічних характеристик двигунів внутрішнього згоряння. NO - як і всі оксиди азоту (крім N2 O), NO - токсичний, при вдиханні вражає дихальні шляхи. Отримання NO є однією зі стадій отримання азотної кислоти.
N2 O3 - застосовується в лабораторії для одержання азотної кислоти та її солей. NO2 - у виробництві сірчаної та азотної кислот, як окислювач в ракетному рідкому паливі та сумішевих вибухових речовинах. N2 O5 - робота з ним вимагає обережності, оскільки реакція його розкладання сильно екзотермічна. Крім того, при розкладанні він дає отруйний NO2.
Фізіологічна дія СО-ОТРУТА! Він з'єднується з гемоглобіном крові, порушуючи тканинне дихання і викликає кисневе голодування тканин. Фізіологічний вплив на людину: 0,01 - до 480 хв. – слабкість, головний біль; 0,05 - до 60 хв. - нудота, посилене серцебиття; 0,1 - до 60 хв. - блювання, втрата свідомості; 0,5 - до 20-30 хв. - смертельне отруєння. СО2 Не токсичний, але не підтримує дихання. Фізіологічний вплив на людину:до 2% - до 480 хв. - частішає дихання; 2 - 5% - до 30 хв.- з'являється шум у вухах, частішає пульс;5 - 8 % - 5 - 10 хв. - сильні головні болі, нездужання; Понад 10% - 1-2 хв. - втрата свідомості, смерть
хімічні властивостіСО – несолетвірний оксид1) Горить синІм полум’ям СО + О2 → 2 СО22) З галогенами СО + Сl2 → СОCl2 (фосген –отрута! )3) Сильний окисник СО +Сu. O →Cu + CO2 СО2 – кислотний оксид1 )Взаємодіє з водою СО2 + Н2 О Н2 СО3 2) З лугами. СО2 +2 Na. ОН→ Na2 СО3 +Н2 О ( середня сіль) СО2 + Na. ОН→ Na. НСО3 (надл. СО2) кисла сіль. Я кісна реакція : СО2 +Сa(ОН)2→ Са. СО3 ↓ + Н2 О3)З оксидами металів СО2 + Вa. О→ Вa. СО3 4) З металами. 2 Мg + CO2 →2 Mg. O + C
Добування 1) С + О2 = 2 СО +Q ( недостаток О2)2) У промисловості: С + СО2 → 2 СО - 175 k. Дж3) В лаборатории: t, Н2 SО4 НСООН Н2 О + СОМуравїна кислота Н2 С2 О4 СО + СО2 +Н2 ОЩавелева кислота1) С + О2 = СО2 +Q (надлишок О2)2) у промисловості: t Са. СО3 → Са. О + СО23) В лабораторії: Са. СО3 +2 НСl → Са. Сl2 +Н2 О + СО2
Застосування СО В суміші з H2 і іншими горючими газами в якості палива;При одержанні спиртів, альдегідів, карбонових кислот та ін.;Відновник у металургії (напр., при виплавці чавуну і сталі);Для обробки м'яса тварин і риби, надає їм яскраво червоний колір і вигляд свіжості, не змінюючи смаку. СO2 У харчовій промисловості використовується як консервант;В якості розпушувача тіста; Сухий лід використовується в якості холодоагенту в морозильних установках;Балони з рідкою вуглекислотою широко застосовуються в якості вогнегасників;Для виробництва газованої води та лимонаду;В якості інертного середовища при зварюванні дротом.
Це- кварц Si. O2 Кварц - один з найпоширеніших мінералів в земній корі. З кремнезему і силікатів складається 87 % маси літосфери. Si. O2 (діоксид кремнію (IV)- найбільш характерний стійкий оксид кремнію. Відомо кілька поліморфних модифікацій Si. O2 (кремнезему), у тому числі кварц, кристоболит і трибимит.r
-
 Теребіленко Людмила Володимирівна 19.01.2019 в 20:28Сподобалась презентацыяЗагальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Теребіленко Людмила Володимирівна 19.01.2019 в 20:28Сподобалась презентацыяЗагальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Супрун Ольга Петрівна 24.10.2018 в 19:24Дякую за презентацію.Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Супрун Ольга Петрівна 24.10.2018 в 19:24Дякую за презентацію.Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку