Презентація "Історія вивчення атома. Ядерна модель атома. Квантові постулати Бора"
Про матеріал
Мета уроку:
- ознайомити учнів з будовою атома;
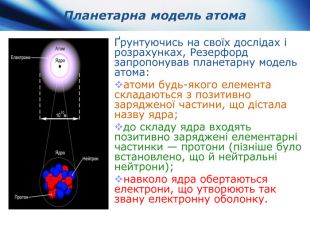
- з'ясувати особливості планетарної моделі атома за Резерфордом;
- вивчити постулати Бора як шлях виходу із кризи класичної фізики;
- розвивати теоретичне та логічне мислення, увагу, спостережливість.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
До підручника
Фізика (рівень стандарту) 11 клас (Сиротюк В.Д., Баштовий В.І.)
До уроку
§ 43. Історія вивчення атома Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку