Презентація на тему: "Хімічний склад клітини. Неорганічні речовини. Вода та її фізико-хімічні речовини"
Про матеріал
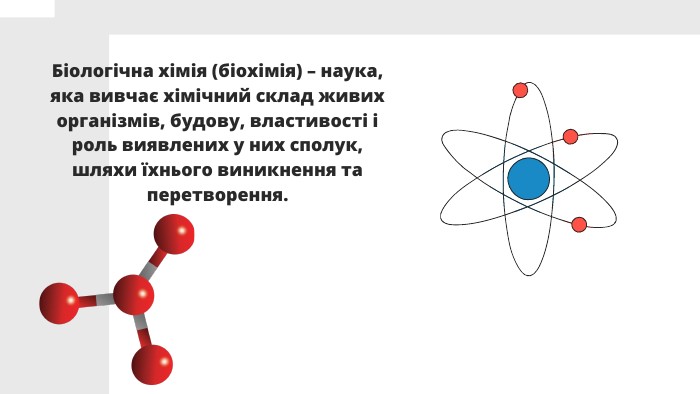
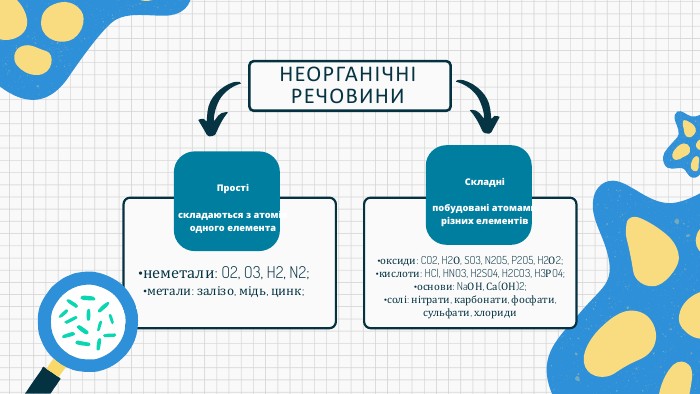
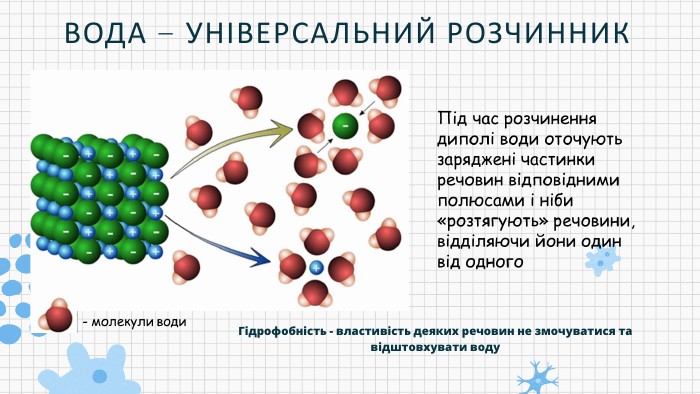
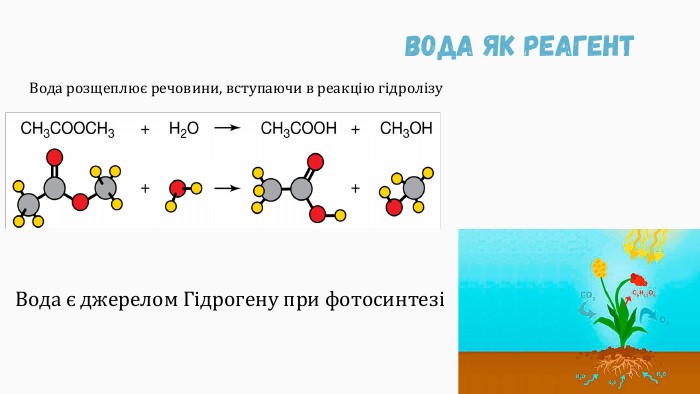
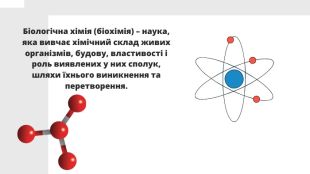
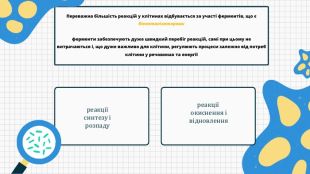
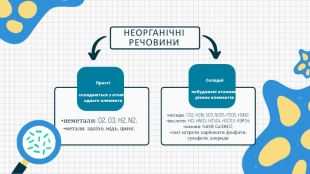
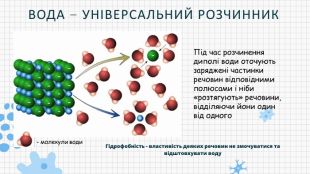
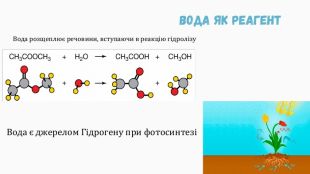
Презентацію складено для учнів 9 класу. В презентації розкрито поняття біохімії, Хімічні елементи у складі біологічних систем, неорганічні речовини. Вода та її особливості.
Список використаних джерел 1. Біологія і екологія (рівень стандарту): підруч. для 9 кл. закл. заг. серед. освіти / В. І. Соболь. – Кам'янець-Подільський : Абетка, 2017.с.12-19
.2. URL: https://uk.wikipedia.org
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку