Презентація "Натрій Калій "
Про матеріал
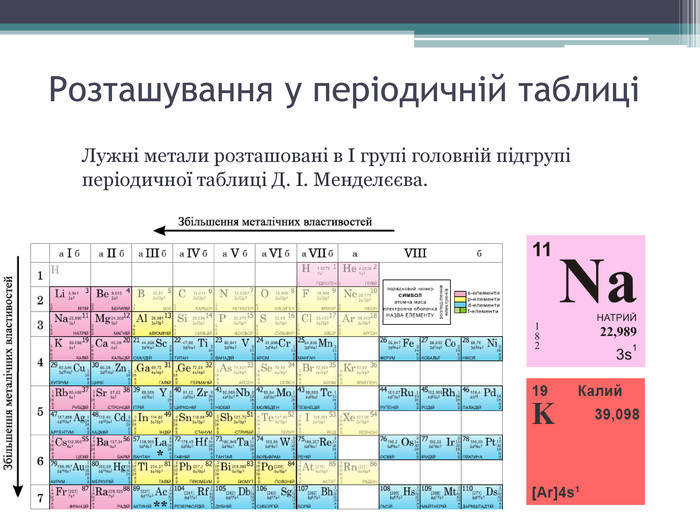
Атоми натрію і калію при хімічній взаємодії легко віддають валентні електрони, переходячи в позитивно заряджені іони: Na і K.
Обидва метали - сильні відновники. На повітрі натрій і калій швидко окислюються, тому їх зберігають під шаром гасу. Вони легко взаємодіють з багатьма неметалами - галогенами, сіркою, фосфором і т.д. бурхливо реагують з водою.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку