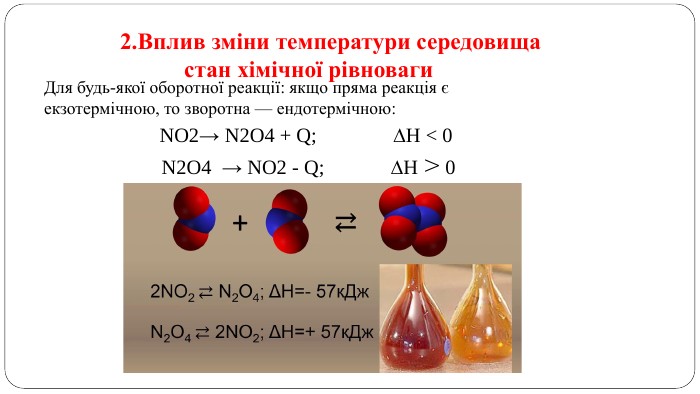
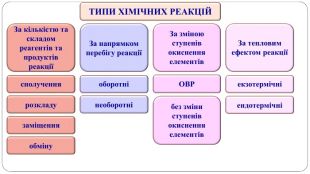
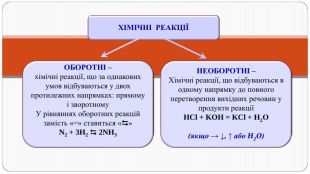
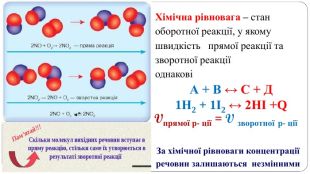
Презентація " Оборотні реакції.Хімічна рівновага.Зміна хімічної рівноваги"
Про матеріал
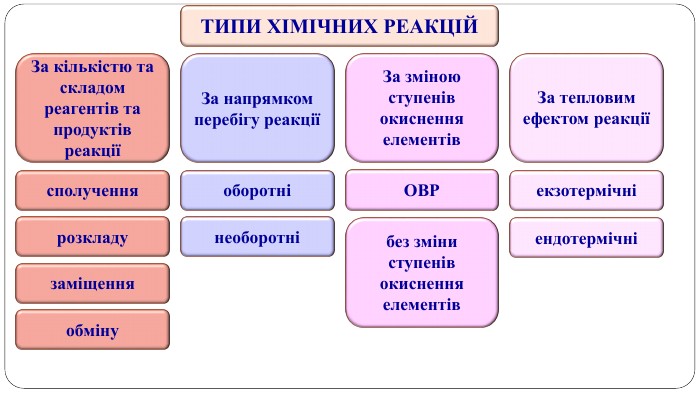
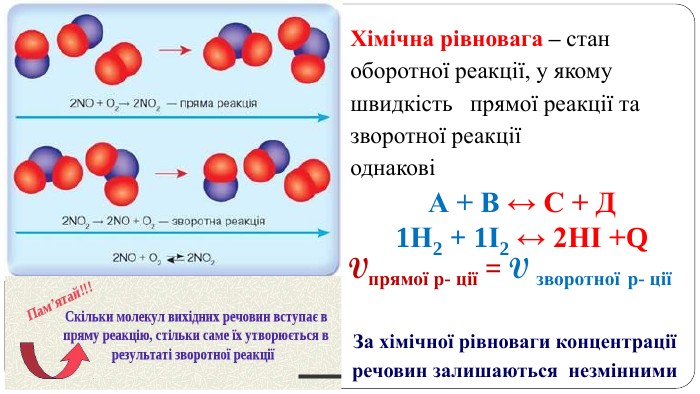
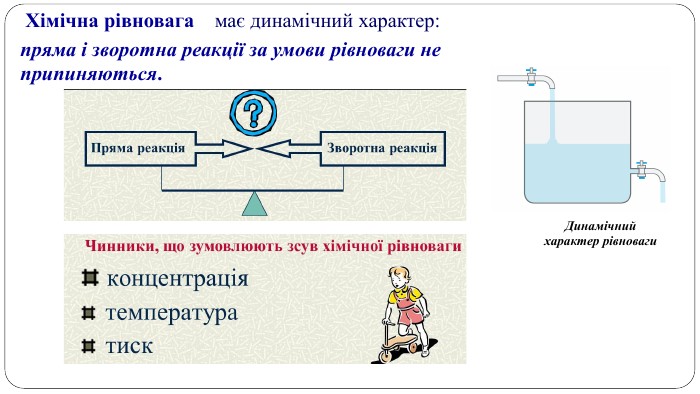
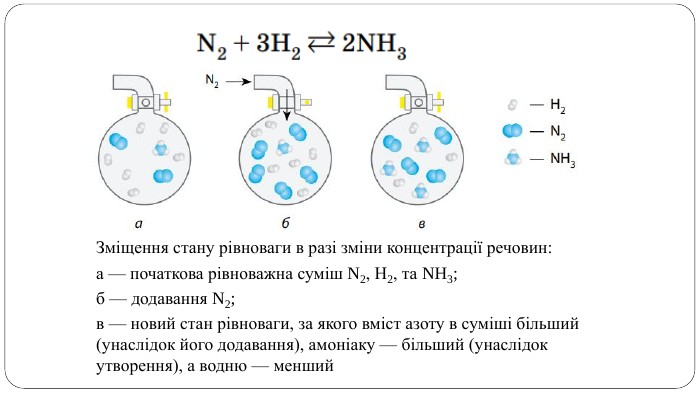
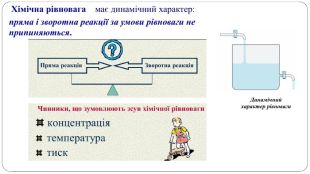
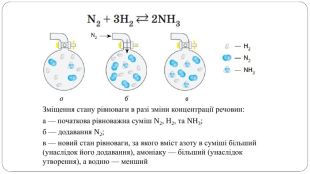
Навчальна презентація містить теоретичний матеріал, схеми і завдання для закріплення. Допоможе учням краще засвоїти тему. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку