Презентація по темі: "Оксиди неметалічних елементів, їх вміст в атмосфері." 2 год.
Презентація по темі: "Оксиди неметалічних елементів, їх уміст в атмосфері." 2 год.
Містить відео.


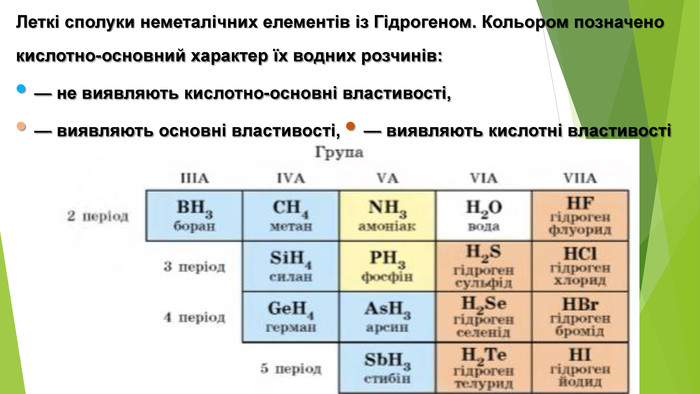
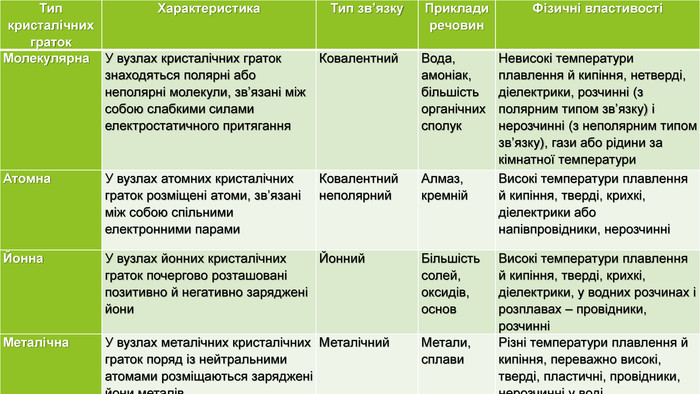

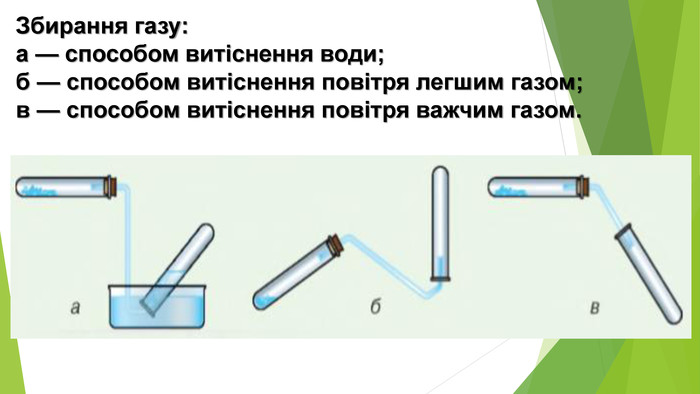










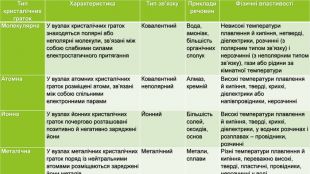
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Тип кристалічних граток. Характеристика Тип зв’язку Приклади речовин. Фізичні властивостіМолекулярна У вузлах кристалічних граток знаходяться полярні або неполярні молекули, зв’язані між собою слабкими силами електростатичного притягання Ковалентний Вода, амоніак, більшість органічних сполук. Невисокі температури плавлення й кипіння, нетверді, діелектрики, розчинні (з полярним типом зв’язку) і нерозчинні (з неполярним типом зв’язку), гази або рідини за кімнатної температури Атомна. У вузлах атомних кристалічних граток розміщені атоми, зв’язані між собою спільними електронними парами. Ковалентний неполярний. Алмаз, кремній Високі температури плавлення й кипіння, тверді, крихкі, діелектрики або напівпровідники, нерозчинніЙонна У вузлах йонних кристалічних граток почергово розташовані позитивно й негативно заряджені йони. Йонний Більшість солей, оксидів, основ. Високі температури плавлення й кипіння, тверді, крихкі, діелектрики, у водних розчинах і розплавах – провідники, розчинніМеталічна. У вузлах металічних кристалічних граток поряд із нейтральними атомами розміщаються заряджені йони металів. Металічний Метали, сплави. Різні температури плавлення й кипіння, переважно високі, тверді, пластичні, провідники, нерозчинні у воді
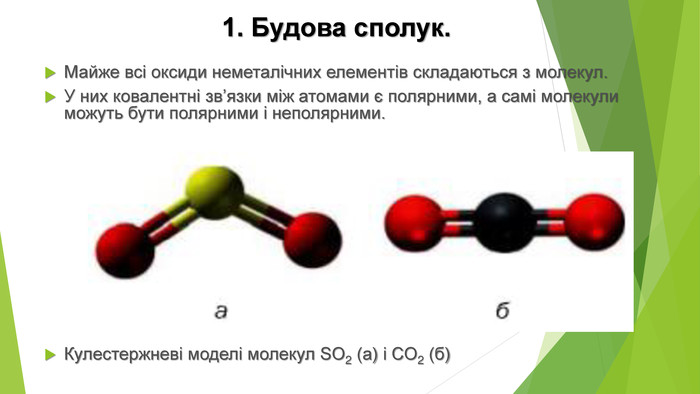
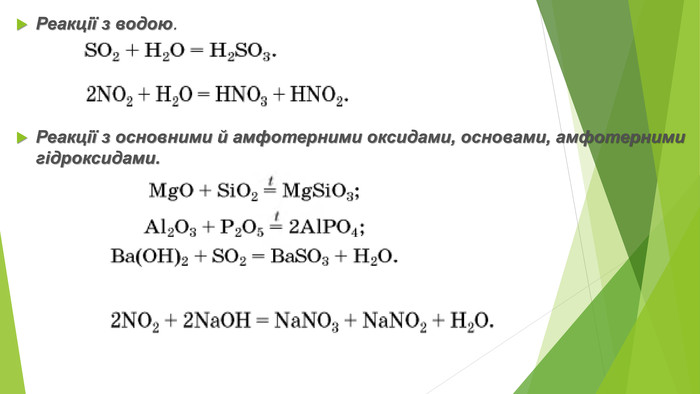
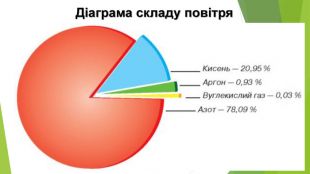
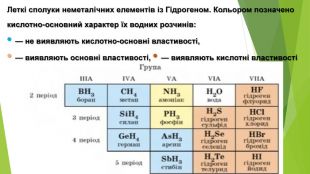
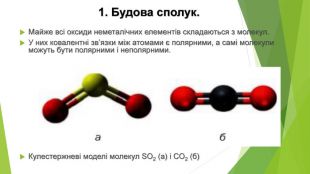
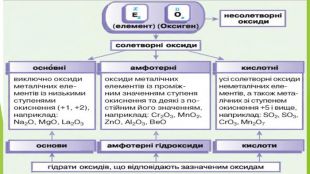
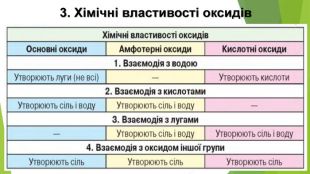
2. Фізичні властивості. Оксиди неметалічних елементів за звичайних умов перебувають у різних агрегатних станах. Так, сполуки SО2, NО2, NO, СО2, CO є газами (перші два мають характерні запахи), N2 О4 — рідина, а оксиди Р2 О5, Si. О2— тверді речовини. Сполуки SО2, SО3, NО2, СО2, Р2 О5 і багато інших оксидів неметалічних елементів розчиняються у воді, взаємодіючи з нею й перетворюючись на кислоти.
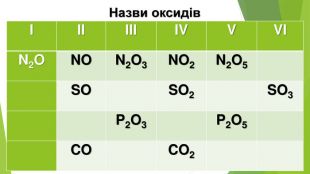
4. Добування. Багато оксидів неметалічних елементів можна добути, здійснивши реакцію між неметалом і киснем. Ці перетворення, як правило, супроводжуються виділенням теплоти, а нерідко й горінням. Не взаємодіють із киснем галогени та інертні гази. Відповідні оксиди добувають за допомогою інших реакцій. Якщо для елемента існує кілька оксидів, то передбачити, який із них утвориться в результаті реакції неметалу з киснем, не завжди вдається. Продуктом горіння вуглецю на повітрі є вуглекислий газ СО2, (іноді — з домішкою чадного газу CO), а сірки — сірчистий газ SО2 (із домішкою оксиду SО3). Взаємодія азоту і кисню, яка відбувається за дуже високої температури, призводить до утворення нітроген(ІІ) оксиду NO, хоча існують інші оксиди Нітрогену.
5. Використання. Деякі оксиди неметалічних елементів набули практичного застосування. Вуглекислий газ використовують у засобах для гасіння пожеж. Він не підтримує горіння і, будучи важчим за повітря, ізолює від нього предмет або речовину, що горить. Сучасні вогнегасники містять зріджений карбон(ІV) оксид, а в старих вуглекислий газ утворювався під час реакції соди із сульфатною кислотою. Додавання цього газу в повітря теплиць прискорює ріст і достигання ранніх овочів. Вуглекислий газ також використовують для приготування газованих напоїв. Карбон(ІІ) оксид входить до складу горючих газових сумішей і слугує вихідною речовиною для синтезу метанолу СН3 ОН. Пісок, який складається переважно із силіцій(ІV) оксиду, застосовують у будівництві, виробництві скла, бетону. Із фосфор(V) оксиду виробляють ортофосфатну кислоту Н3 РО4.
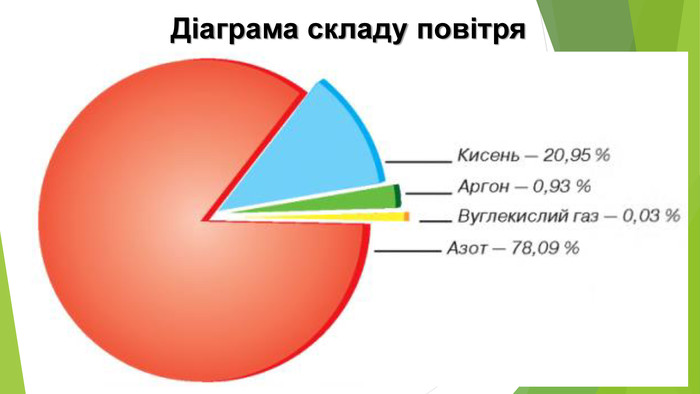
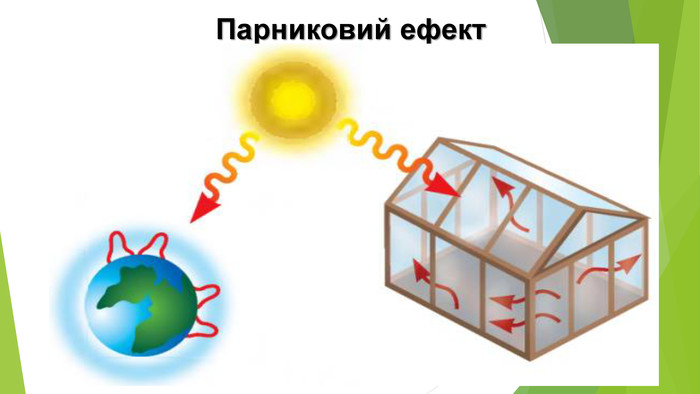
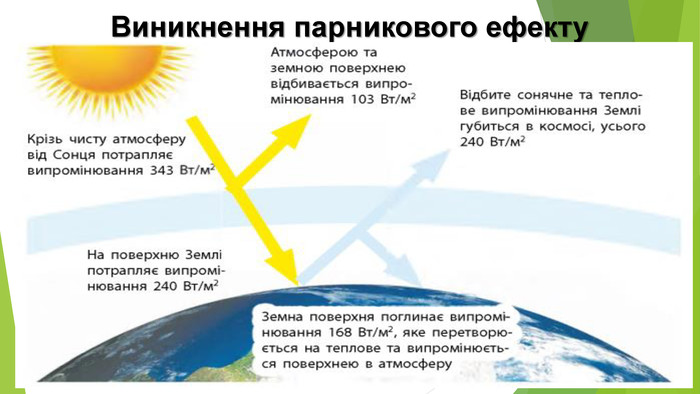
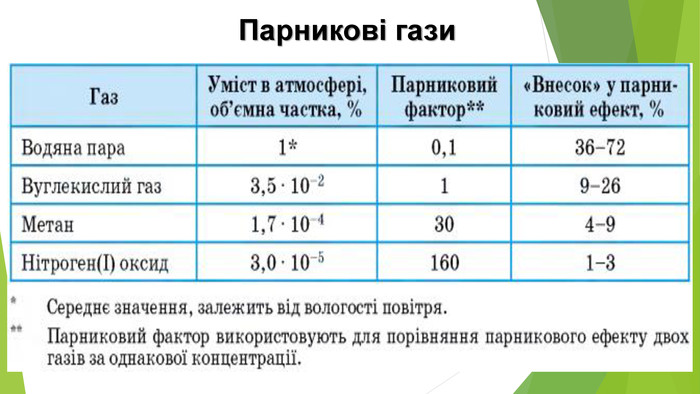
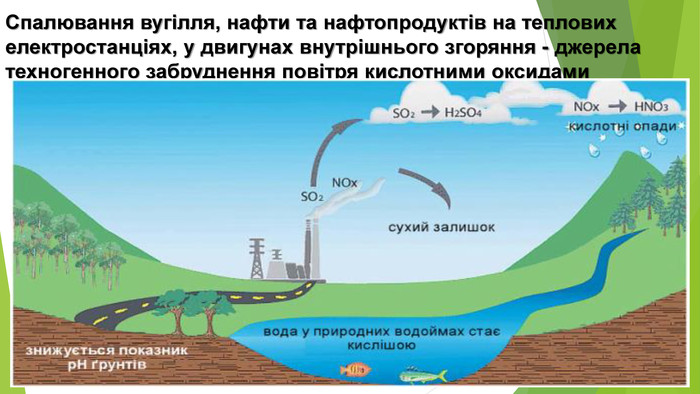
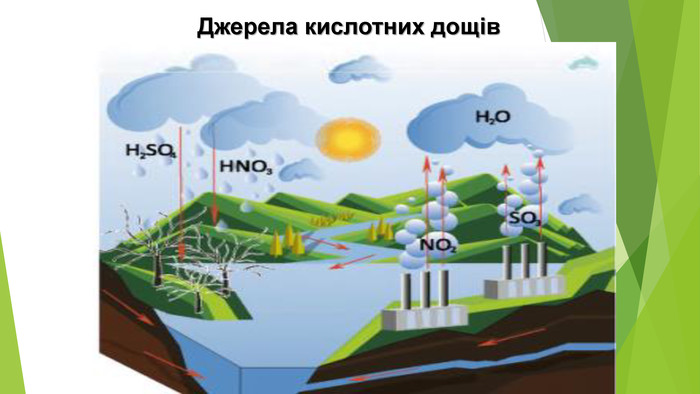
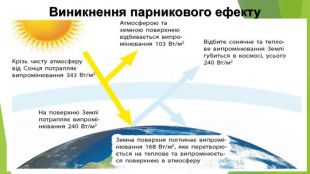
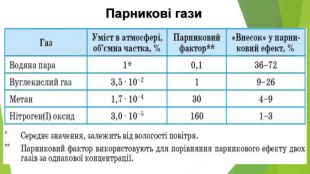
6. Оксиди неметалічних елементів і довкілля. Особливе значення серед оксидів для навколишнього середовища має вода. Ця речовина бере участь у геологічних процесах, змінює рельєф планети, впливає на клімат і погоду. Усі процеси в живих організмах відбуваються у водних розчинах. Роль карбон(ІV) оксиду, або вуглекислого газу, не менш важлива. Сполука разом із водою бере участь у фотосинтезі, регулює тепловий баланс на Землі. Вуглекислий газ здатний поглинати ці промені і, незважаючи на малий вміст в атмосфері (φ (СО2) ≈ 0,04 %), затримує частину теплоти на Землі. Таке явище називають парниковим ефектом. Негативний вплив на довкілля створюють домішки в повітрі оксидів NО2 і SО2. Вони містяться в газових викидах металургійних, теплоенергетичних підприємств, автотранспорту. Ці оксиди беруть участь в утворенні смогу над великими містами і промисловими центрами. Внаслідок їх взаємодії з атмосферною вологою трапляються кислотні опади.
7. Фізіологічна дія оксидів. Більшість оксидів неметалічних елементів токсичні. Чадний газ дуже отруйний. Він не має запаху, і людина його не відчуває. Відомі випадки смертельного отруєння людей чадним газом через погану тягу в будинках із пічним опаленням, а також у гаражах за тривалої роботи автомобільного двигуна. За одну годину двигун автомобіля може «виробити» від 3 до 6 м3 чадного газу. У сучасних автомобілях вихлопні гази проходять через каталізатори. Завдяки їм відбуваються реакції карбон(ІІ) оксиду і залишків пального з киснем повітря. Продуктами таких реакцій є вуглекислий газ і вода. Вуглекислий газ не вважають токсичною речовиною. Однак якщо об’ємна частка цього газу в повітрі досягає 0,25 %, людина починає відчувати задуху. Висока концентрація карбон(IV) оксиду може спричинити смерть через зупинку дихання.
1. Напишіть по одній формулі оксидів неметалічних елементів різного складу.2. Яких значень можуть набувати індекси у загальній формулі оксидів?3. Чому гідроген пероксид Н2 О2 не зараховують до оксидів?4. Допишіть схеми реакцій і складіть хімічні рівняння:a) SО2 + О2 —> б) СО2 + Mg. O —>в) SО3 + Н2 О —> г) Р2 О5 + Li. OH —> 5. За матеріалами з інтернету або іншими джерелами інформації підготуйте невелике повідомлення про вплив оксидів Нітрогену на організм людини. 6. Який із газів важчий — вуглекислий чи чадний? У скільки разів? 7. Обчисліть середню молярну масу та густину за воднем суміші оксидів Карбону, якщо об’єм чадного газу в ній втричі більший за об’єм вуглекислого газу. 8. На спалювання 3,8 г суміші метану і чадного газу витрачено 10,4 г кисню. Обчисліть маси газів у суміші.9. Елемент VI групи утворює два оксиди. Один з них містить 50 % Оксигену за масою і має відносну молекулярну масу, що в 1,25 раза менша за відносну молекулярну масу іншого оксиду. Виведіть формули оксидів.10. Обчисліть, чи вистачить кисню об’ємом 140 л (н. у.) для добування алюміній оксиду кількістю речовини 2 моль. 11. Визначте масу магній карбонату, яку необхідно розкласти, щоб утвореного вуглекислого газу (н. у.) вистачило для взаємодії з кальцій гідроксидом масою 3,7г.


про публікацію авторської розробки
Додати розробку

















-

Чепак Галина Олександрівна
19.03.2023 в 15:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
11.01.2023 в 22:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
21.12.2022 в 19:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Заяць Євдокія Дмитрівна
11.02.2022 в 13:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
11.02.2022 в 12:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Юрченко Оксана
14.01.2022 в 22:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Земелько Катерина Олександрівна
14.11.2021 в 21:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Романенко Євгенія Леонідівна
26.01.2021 в 20:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кривобородько Віра Борисівна
15.01.2021 в 20:23
Дякую за презентацію, колего! Бажаю натхнення у роботі та вдячних учнів.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 6 відгуків