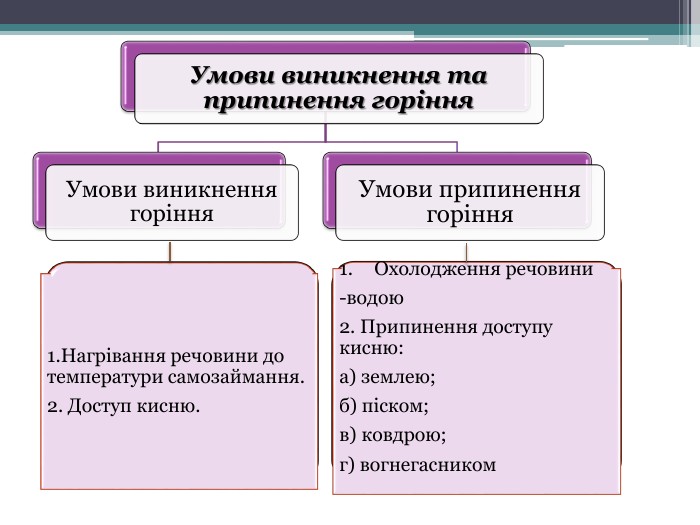
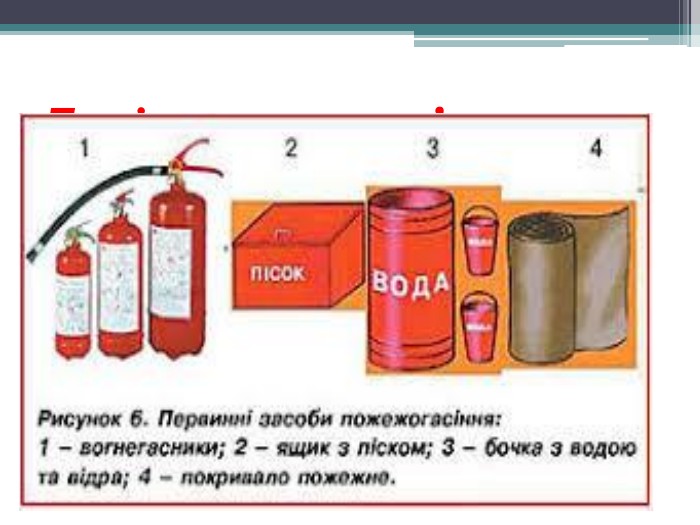
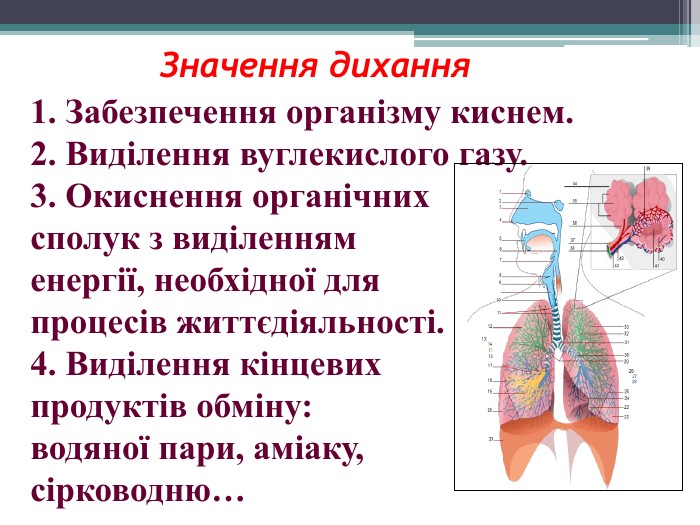
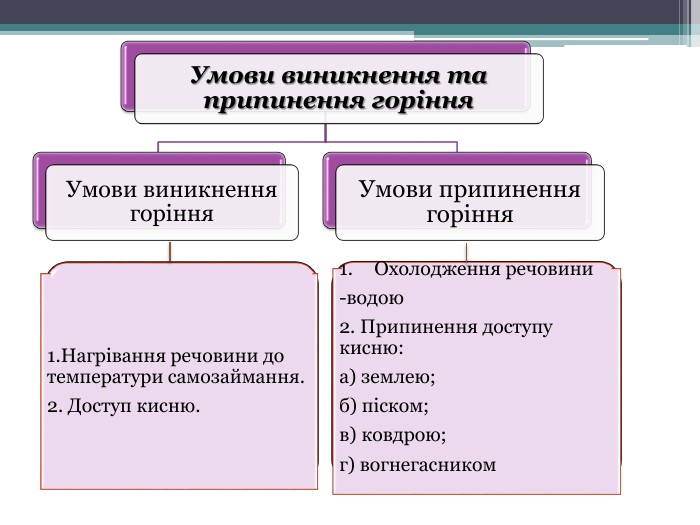
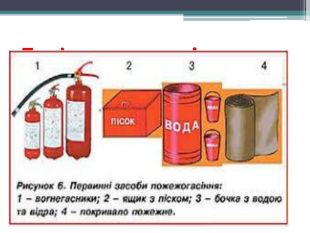
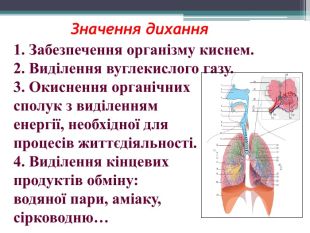
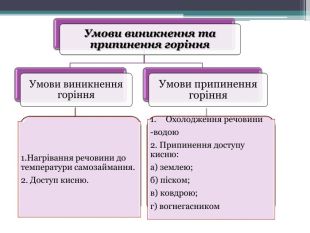
Презентація "Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання)"
Про матеріал
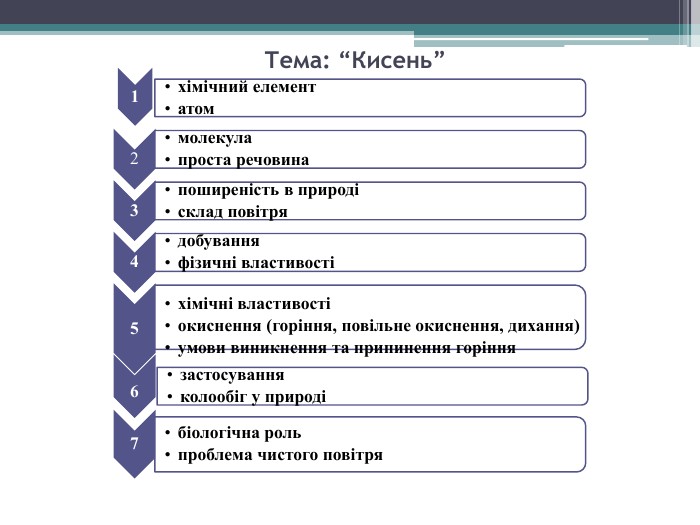
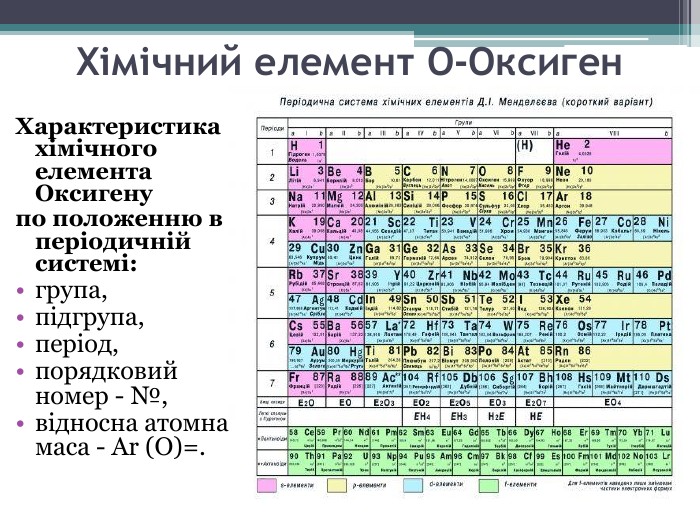
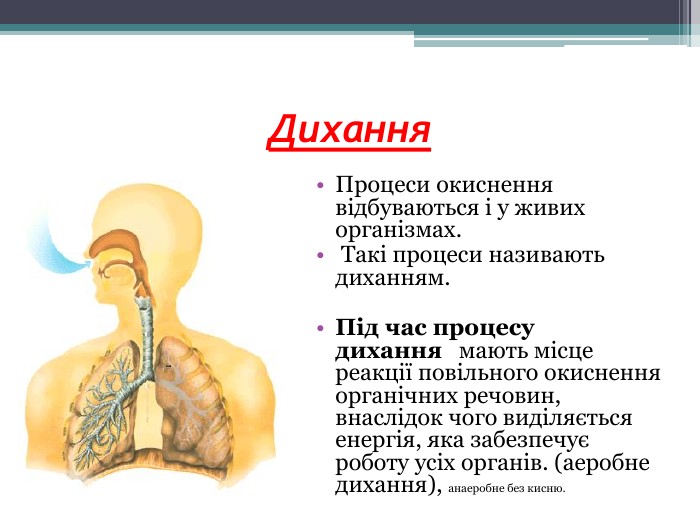
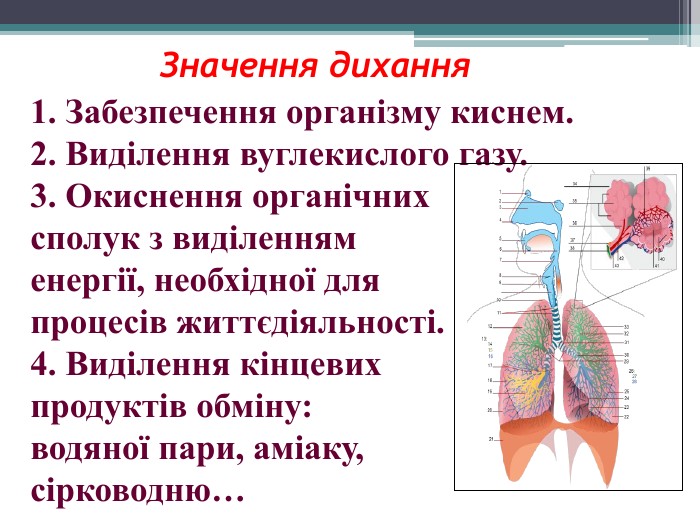
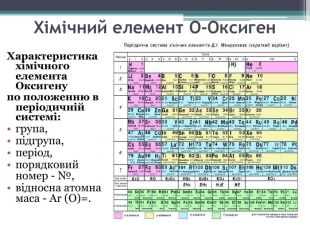
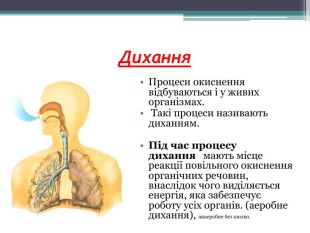
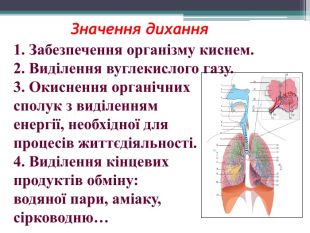
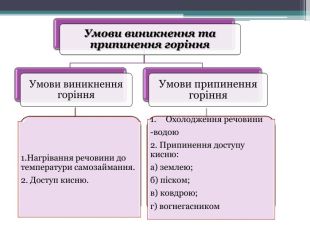
Презентація до уроку з теми: "Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання)". 7 клас Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую.
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку