Презентація з хімії по темі «Гідроліз солей».




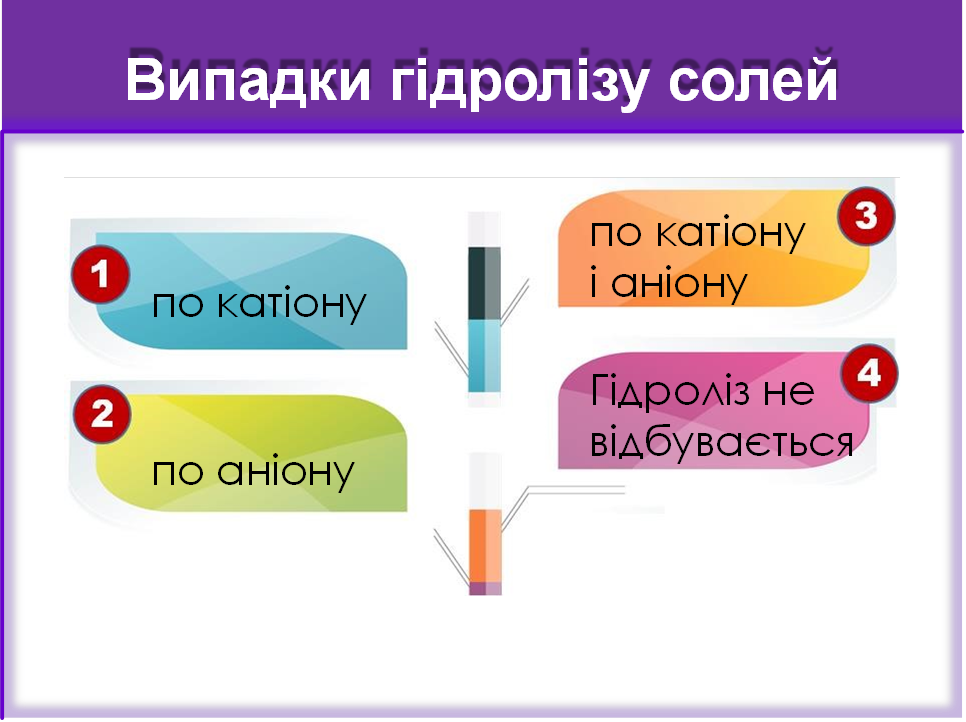


3 Гідроліз по катіону і аніону
CH3COONH4 ⇆CH3COO−+NH4+ Нейтральна
слабк. слабк. реакція середовища
H2O⇄H++OH− pH = 7
CH3COO−+NH4++H++OH− →CH3COOH+N𝐻4𝑂𝐻
Залежно від здатності до дисоціації слабких електролітів середовище водних розчинів солей,
 утворених слабкими основою і кислотою, може бути нейтральним, слабколужним або слабкокислим.
утворених слабкими основою і кислотою, може бути нейтральним, слабколужним або слабкокислим.

Правила написання рівнянь гідролізу
гідроліз – процес оборотний; реакцію середовища зумовлює сильний електроліт;
 якщо йон солі, що взаємодіє з водою, багатозарядний, то гідроліз протікає ступінчасто ( число ступенів збігається із зарядом йона);
якщо йон солі, що взаємодіє з водою, багатозарядний, то гідроліз протікає ступінчасто ( число ступенів збігається із зарядом йона);
сумарний заряд лівої і правої частин йонних рівнянь гідролізу має бути однаковий (перевірка рівняння).





про публікацію авторської розробки
Додати розробку
