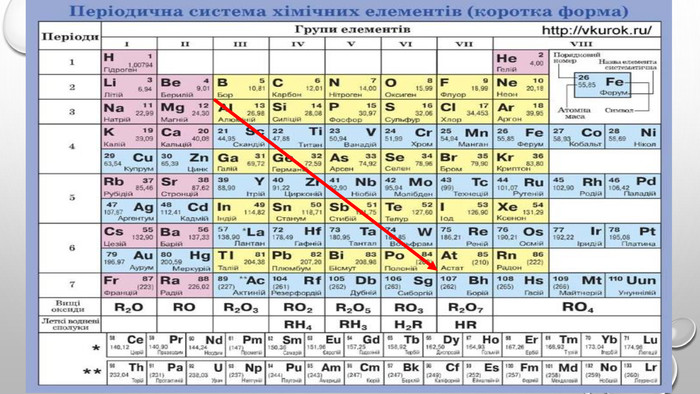
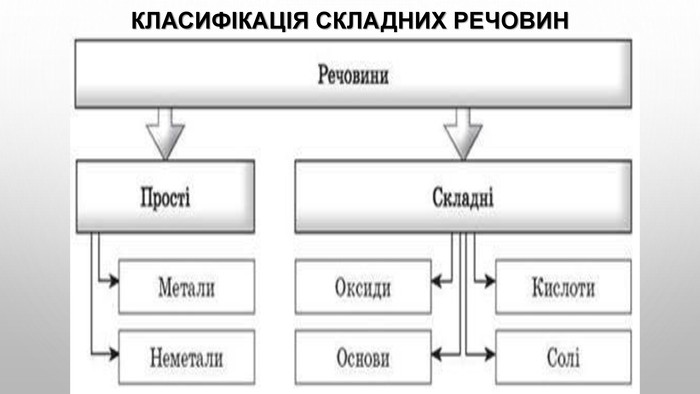
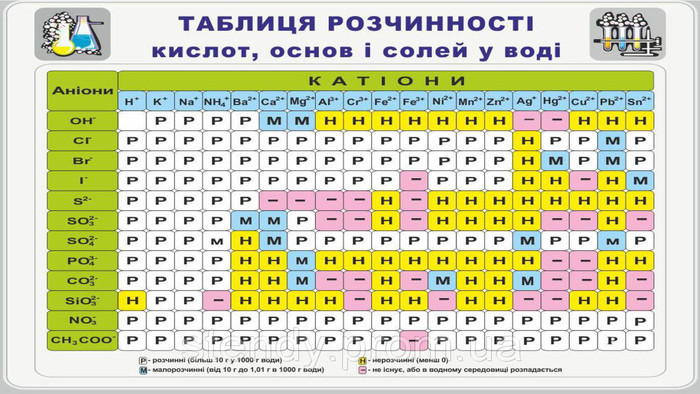
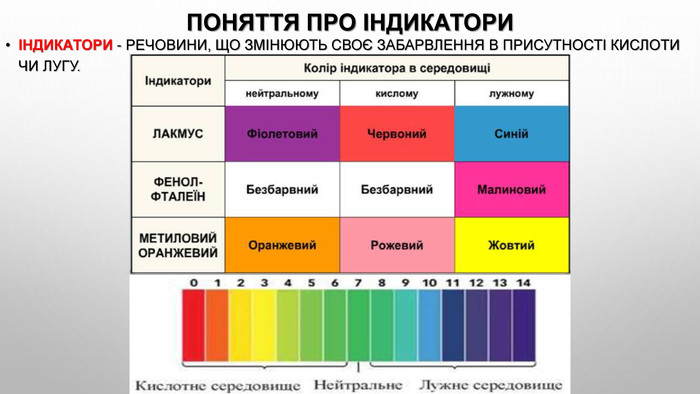
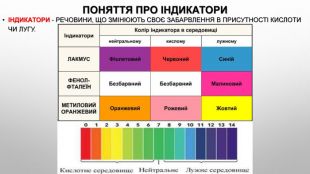
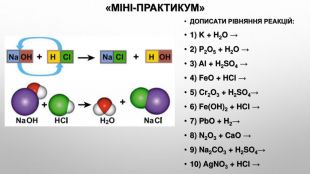
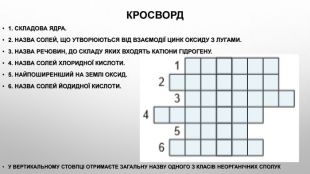
Презентація з теми: "Взаємодія води з оксидами. Поняття про кислоти й основи. Поняття про індикатори"
Про матеріал
Презентація з теми: "Взаємодія води з оксидами. Поняття про кислоти й основи. Поняття про індикатори".
Містить відео. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
-
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку