Розрахункові задачі. Обчислення масової частки, маси розчиненої речовини, маси і об’єму води в розчині.
Вчитель хімії та біології Гавриляк Мар’яна Володимирівна
Тема уроку: Розрахункові задачі. Обчислення масової частки, маси розчиненої речовини, маси і об’єму води в розчині.
Мета:
Навчальна: закріпити знання про масову частку розчиненої речовини; формувати навички і вміння обчислювати масову частку та масу розчиненої речовини, масу розчину, масу води у розчині; підготувати учнів до практичної роботи з приготування розчинів;
Розвивальна: розвивати самостійність, творчу активність, логічне мислення, уміння аналізувати, порівнювати, узагальнювати, робити висновки;
Виховна: виховувати дбайливе ставлення до свого здоров’я та слідкувати за осанкою учнів.
Тип уроку: застосування знань, умінь і навичок.
Форми роботи: розв’язання задач, індивідуальна і групова робота.
Обладнання: таблиця розчинності, картки-завдання.
Хід уроку:
І. Організація класу. Перевірка присутності і готовності учнів до уроку. Відповіді на запитання учнів. Учні розподіляються на 4 групи .
ІІ. Мотивація уроку.
Працюючи з розчинами, важливо знати, скільки розчиненої речовини міститься в них, знати кількісний склад розчинів, бо в медицині, наприклад, в залежності від кількості речовини розчини можуть бути шкідливими або корисними.
Сьогодні на уроці ми розглянемо різні типи задач на розчини.
ІІІ. Повідомлення теми, мети уроку.
На всіх етапах уроку учні працюють у складі груп. Результати роботи записуються консультантами в листку успішності
IV. Актуалізація знань.
Актуалізація знань учнів проводиться як повторення понять «розчин», «насичений розчин», «ненасичений розчин», «розбавлений розчин», «концентрований розчин»:
А) Прийом «Мозковий штурм»
1) Що таке розчин? Які компоненти він містить?
(Розчин – це однорідна (гомогенна) система змінного складу, яка містить розчинену речовину, розчинник і продукти їх взаємодії).
2) Що таке розчинник?
(Розчинник – компонент розчину, що перебуває у тому самому агрегатному стані, що й розчин).
3) Як позначається масова частка розчиненої речовини? (W).
4) У чому виражається масова частка? (У відсотках).
5) Що таке насичений розчин?
( Наси́чений ро́зчин — розчин, в якому розчинена речовина за даних умов досягла максимальної концентрації і більше не розчиняється.)
6) Що таке ненасичений розчин?
( Ненасичений розчин – це розчин, у якому при даній температурі речовина ще може розчинятися.)
7) Що таке розбавлений розчин?
(Розбавлений розчин - це розчин з малою концентрацією розчиненої речовини (далекий від насичення)
8) Що таке концентрований розчин?
( Концентрований розчин - це розчин з великою кількістю розчиненої речовини в одиниці об'єму розчину або розчинника.)
V. Розв’язування задач.
А) пИСЬМОВО: Кожна група отримує картку-завдання:
І група.
3і шафи впала склянка, де було 700 г розчину натрій гідроксиду з масовою часткою натрій гідроксиду 10%. Скільки грамів води та скільки грамів лугу візьме лаборант для виготовлення такої ж самої маси з такою ж самою концентрацією NaOН нового розчину?
ІІ група.
Учень виконує практичну роботу. Йому треба приготувати 100 г розчину NaCl з масовою часткою солі 7%. Скільки йому потрібно взяти солі та води.
ІІІ група.
Визначте масу води для приготування розчину калій нітрату KNO3 з масовою часткою солі 20%, в якому міститься 50 г KNO3
IV група.
В якій масі води необхідно розчинити 1,8 г натрій хлориду NaCl, щоб отримати фізіологічний розчин з масовою часткою натрій хлориду 0,09 %.
Б) Вправа «Навмисна помилка » (Учням пропонується знайти помилки у розв’язанні задач):
І група. До 15 г солі додали 285 мл води. Визначити масову частку солі в розчині.
![]() Дано:
Дано:
m(солі) = 15 г W = ![]() *100%
*100%
m(H2O) = 285 мл = 285 г
![]() W(солі) - ? W(солі) = 15/285 *100% = 0,052 * 100% = 5,2%
W(солі) - ? W(солі) = 15/285 *100% = 0,052 * 100% = 5,2%
Відповідь: W(солі) = 5,2%
ІІ група. Обчисліть масу солі й води, необхідні для приготування розчину
масою 400 г з масовою часткою розчиненої речовини 15%;
![]() Дано:
Дано:
m(розч.) = 400 г ![]() = m(розч.) * W
= m(розч.) * W
W(солі) = 15% m (солі) = 400 г * 0,15 = 60 г
![]() m (солі) - ? m(H2O) = 400 г + 60 г = 460 г
m (солі) - ? m(H2O) = 400 г + 60 г = 460 г
m(H2O) - ? Відповідь: m (солі) = 60 г; m(H2O) = 460 г
ІІІ група. Обчисліть масу солі й води, необхідні для приготування розчину масою 450 г з масовою часткою розчиненої речовини 16%;
![]() Дано:
Дано:
m(розч.) = 450 г ![]() = m(розч.) * W
= m(розч.) * W
W(солі) = 16% m (солі) = 450 г * 0,16 = 72 г
![]() m (солі) - ? m(H2O) = 450 г + 72 г = 522 г
m (солі) - ? m(H2O) = 450 г + 72 г = 522 г
m(H2O) - ? Відповідь: m (солі) = 72 г; m(H2O) = 522 г
IV група. Обчисліть масу солі й води, необхідні для приготування розчину масою 550 г з масовою часткою розчиненої речовини 20%.
![]() Дано:
Дано:
m(розч.) = 550 г ![]() = m(розч.) * W
= m(розч.) * W
W(солі) = 20% m (солі) = 550 г * 0,2 = 110 г
![]() m (солі) - ? m(H2O) = 550 г + 110 г = 660 г
m (солі) - ? m(H2O) = 550 г + 110 г = 660 г
m(H2O) - ? Відповідь: m (солі) = 110 г; m(H2O) = 660 г
VI. Осмислення знань, умінь.
З обчисленнями масової частки чи маси розчиненої речовини, а також маси розчину й розчинника кожна людина має справу у повсякденному житті. Так, приготування настоянок трав, використання ліків у вигляді розчинів, консервування овочів, приготування варення й компотів, користування мийними засобами тощо – приклади, що доводять необхідність кожному з вас: розумітися на цих обчисленнях.
Розчини зберігають за температури 15-20 °С у щільно закритих посудинах, виготовлених з інертних матеріалів (поясніть, чому). На кожній посудині з розчином має бути етикетка (поясніть, чому). На ній зазвичай зазначають розчинник, масову частку розчиненої речовини, дату виготовлення розчину.
Запам'ятайте! Тривале й неправильне зберігання може призвести до псування розчину аж до повної непридатності - появи пластівців і каламуті, зміни кольору й складу тощо.
А) Вправа «Ланцюжок»
Кожна група по ланцюжку називає послідовність дій виготовлення розчину:
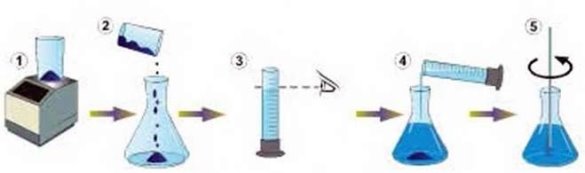
Б) Самостійна робота. Вправа «Хто більше?» (Яка група розв'яже
більше задач за певний проміжок часу)
1. Для консервування огірків, помідорів, кабачків готують маринади з дотриманням певного вмісту солі, цукру, оцту у воді. Для їх приготування необхідно знати масу розчиненої речовини (розчинених речовин) та масу води. Яка маса натрій хлориду (кухонної солі) і води потрібна для приготування розчину масою 5 кг з масовою часткою солі 5 %
2. Яку масу солі слід розчинити у воді масою 540 г, щоб отримати розчин з масовою часткою розчиненої речовини 10 %?
3. У морській воді масова частка солей становить приблизно 13,4 %. Яку масу морської солі можна здобути повним випарюванням 5 кг такої води?
4. Змішали розчин глюкози масою 50 г з масовою часткою розчиненої речовини 20 % і розчин масою 200 г з масовою часткою глюкози 10 %. Обчисліть масову частку глюкози у виготовленому розчині.
5. До 450 г розчину з масовою часткою кухонної солі 24 % додали ще 50 г цієї самої солі. Яка масова частка солі в утвореному розчині?
VIІ. Ознайомлення учнів з табличним способом розв’язування задач.
Учні по колу виконують задачі, умови яких представлені у таблиці:
|
№ з/п |
m (розч.), г |
m (розч. реч.), г |
m (H2O), г |
W, % |
|
1 |
200 |
|
180 |
|
|
2 |
|
50 |
|
20 |
|
3 |
150 |
50 |
|
|
|
4 |
120 |
|
|
5 |
VIIІ. Рефлексія
Найбільше мене вразило …
Найбільше мені сподобалась вправа …
На наступному уроці я б хотів дізнатися …
ІХ. Виставлення оцінок з поясненням.
Х. Підведення підсумків уроку, повідомлення домашнього завдання:
Різнорівневі завдання:
4 – 6 балів – Обчисліть масову частку розчиненої речовини в розчинах з таким складом: маса розчину – 1200 г, маса розчиненої речовини – 300 г;
7 – 9 балів - З розчину цукру масою 300 г з масовою часткою розчиненої речовини 6 % випарили 100 г води. Визначте масову частку цукру в отриманому розчині.
10 – 12 балів - На етикетці йодної настоянки вказано “Спиртовий розчин йоду, 5 %, 20 мл”. Обчисліть масу розчиненої речовини й розчинника в одному флаконі, прийнявши густину розчину за 1 г/мл.
ДОСЛІДЖУЄМО НА ВДОМА:
Для полоскання горла, при зубних болях ефективним є використання розчину харчової соди з масовою часткою розчиненої речовини 10 %. Здійсніть необхідні розрахунки і приготуйте 200 г такого розчину. Якщо маєте вдома терези, проведіть на них зважування. Якщо терезів немає, то врахуйте, що маса соди в 1 чайній ложці становить в середньому 10 г. Приготуйте розчин, використавши кип’ячену воду кімнатної температури.
Помістіть готовий розчин у банку з кришкою, що щільно прилягає, і закрийте її. Перевірте банку на герметичність, перевернувши догори дном. Наклейте на банку етикетку із зазначенням масової частки соди у виготовленому вами розчині. Зберігайте розчин у домашній аптечці, а в разі необхідності використовуйте розчин злегка підігрітим.


про публікацію авторської розробки
Додати розробку
