Розробка заняття " Реакції йонного обміну"
В розробці представлені матеріали для формування вмінь і навичок складання йонних рівнянь реакцій.
Тема уроку : Реакції йонного обміну в розчинах електролітів .
Мета уроку :
-закріпити поняття : електроліти, неелектроліти, електролітична дисоціація, сильні і слабкі електроліти , реакції йонного обміну;
- систематизувати знання про властивості основних класів неорганічних сполук з точки зору електролітичної дисоціації ;
- розвивати та удосконалювати навички та вміння складати повні , скороченні йонні рівняння реакцій обміну з використанням таблиці розчинності солей, кислот, лугів ; прогнозувати хід реакцій і підбирати вихідні речовини за скороченими рівняннями для здійснення відповідних реакцій ;
-формувати практичні навички проведення хімічного експерименту , самостійно виконувати завдання, робити обгрунтовані висновки стосовно оборотності хімічних реакцій в пошуках зв’язку теорії та практики, розвивати елементи творчості та відповідності за прийняте рішення , пізнавальний інтерес, хімічну пам’ять та мову ; підготувати учнів до практичної роботи .
- виховувати бережливе ставлення до хімічного обладнання, почуття економного використання реактивів під час проведення хімічних експериментів , естетичні смаки та охайність в оформленні записів .
Тип уроку : Формування практичних вмінь та навичок
Обладнання та реактиви :
Періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності солей, кислот , лугів у воді , алгоритм – схема запису реакцій йонного обміну, штатив з пробірками, індикатори : метиловий оранжевий, фенолфталеїн, розчини речовин : нітратна кислота, калію гідроксиду, натрію гідроксиду, натрію хлориду, калій карбонату, ферум(ІІІ) сульфату,комп’ютер,мультимедійний проектор.
Хід уроку
І. Організаційний етап.
ІІ.Мотиваційний етап .
ІІІ. Актуалізація раніше набутих знань :
1) Продовжи речення ;
2) П’ятий зайвий ;
3) Складіть формули речовин , що можуть бути утворені такими йонами ;
4) Вибери електроліт : дидактична гра « Хрестики нулики»
5) Вірю – не вірю
6) Видатний вчений ( Арреніус). Повідомлення учнів.
ІV. Керована практика .
1) Поняття про йонні реакцї та умови їх проходження :
2)Перегляд відеофрагментів та запис йонних рівнянь реакці на дошці .
3)Виконання лабораторного досліду за інструкцією до роботи , інструктаж з техніки
безпеки .
4)Виконання тестової роботи .
V. Узагальнення та систематизація вивченого :
Слідство ведуть хіміки .
VІ. Домашнє завдання .
VІІ. Рефлексія .
ХІД УРОКУ
1.Організаційний етап.
Добрий день ! Давньогрецька мудрість говорить:“ Вважай нещасливим той день і ту годину, коли не засвоїв нічого нового » .
Сьогодні на уроці хочу я знайти
У вас те,що іншим непомітно:
Відвагу - в скромних
Доброту - в черствих,
В лінивих – працелюбність,
Жагу до знань у всіх-
І непомітно струни так торкнути,
Щоб звуки всі злились в однин оркестр.
Назва якому успішний урок.
Я сподіваюсь, що ми сьогодні будемо працювати активно,успішно,а головне разом,а дух партнерства допоможе нам у цьому.Нехай для кожного з вас стануть девізом слова академіка А.Н.Несміянова :
«Тисячі нерозгаданих таємниць містять в собі науки, і без вас, без вашої молодості, захопленості вони не будуть розгадані . Науки чекають на вас, друзі!»..
ІІ. Мотиваційний етап .
У темі « Хімічні реакції» ви ознайомилися з різними типами хімічних реакцій.Цей розділ має важливе практичне значення,так як більшість виробництв хімічної,фармацевтичної, металургійної,нафтохімічної,харчової,текстильної та інших галузей промисловості базуються на хімічних реакціях.А також хімічні реакції відбуваються в живих організмах, бо живі організми – велика біолабораторія,де відбувається сотні тисяч хімічних реакцій,серед яких і реакції йонного обміну.Суть кожної реакції йонного обміну зводиться до взаємодії між йонами.
ІІІ. Актуалізація раніше набутих знань .
Наше спілкування почнемо з наступних вправ:
1.Продовжи речення :
- речовини,розчини і розплави яких проводять електричний струм,називаються …
( електролітами)
- до електролітів належать …( розчини основ, кислот, солей)
- електролітами можуть бути тільки речовини (з йонним та ковалентним полірним)…. типом хімічного зв’язку.
- неелектролітами називаються речовини…
- електролітичною дисоціацією називають …( розпад на йони )
- для того,щоб електроліт розщеплювався у розчині на йони,молекули розчинника повинні бути …( полярними )
- двох- і багатоосновні кислоти дисоціюють ( ступінчасто)
- величина,яка характеризує повноту розщеплення електроліту на йони називається …
( ступенем електролітичної дисоціації )
2. « П’ятий зайвий »
a) Речовини,що добре розчиняються у воді : NaCI, BaSO4, KNO3, KOH, HNO3.
б) Речовини сильні електроліти : НNO3, NaОН, Н3РО4, КОН,О2 .
в) Йони,які рухаються до катоду під час пропускання через розчин електричного струму:
К+,ОН-,АІ3+,Са2+,Fe 3+ .
3.Складіть формули речовин , що можуть бути утворені такими йонами :
Н+, Са2+, Ва2+, СІ-, SO42- ( НСІ, Н2 SO4 ,СаСІ2, Са SO4 , ВаСІ2, Ва SO4 )
4. Вибери електроліт : дидактична гра « Хрестики нулики»
|
НВг
|
Фруктоза |
Ва(ОН)2 |
|
НСІ |
КNО3 |
лактоза |
|
NaОН |
КСІ |
Н2SO4
|
СаСО3 |
NaОН |
Н2S |
|
|
Глюкоза
|
СаО |
Дистильована вода |
цукор |
ВаСІ2 |
Fe(ОН)3 |
5. « Вірю – не вірю »
1. Компонент розчину,який перебуває в тому самому агрегатному стані,що й розчин, називається розчинником. ( + )
2. Розчини,які проводять електричний струм називають неелектролітами. ( - )
3.Розчини,які містять мало розчиненої речовини,називаються розведеними ( + )
4.Розчин,в якому певна речовина за даної температури ще може розчинятися,називається
насиченим .( -)
5. Процес дисоціації – необоротний ( - ) .
6.Позитивно заряджені йони називаються катіонами.( +)
7.Ступінь дисоціації завжди менший одиниці .(+).
8.Під час дисоціації лугів утворюються аніони кислотного залишку. (-) .
9.Під час дисоціації кислот утворюються катіони лише одного типу – гідроген–йони ( +) .
10.Кислоти,основи,солі належать до нелектролітів. ( -) .
11.Оксиди і прості речовини під час розчинення на йони не розпадаються.( +) .
6. «Видатний вчений » ( Арреніус)
|
|
AI3+ |
H+ |
Ag+ |
CI- |
Fe3+ |
OH- |
SO42-
|
|
Катіони, які присутні в розчині алюміній сульфату |
А |
К |
О |
З |
В |
Г |
Р
|
|
Аніони, які присутні в розчині сульфатної кислоти |
В |
М |
Ч |
А |
І |
М |
Р
|
|
Аніон, який зв’язує йони Купрум(ІІ) |
Т |
С |
П |
З |
Н |
Р |
К
|
|
Йони, присутні в розчинах лугів |
М |
Д |
Ц |
М |
О |
Е |
У
|
|
Йони, присутні в розчинах кислот |
Г |
Н |
Ш |
Е |
У |
А |
С
|
|
Йони, якими визначають хлорид – йон |
Ф |
Н |
І |
В |
Я |
Л |
Т
|
|
Йони, якими утворюється молекула води |
М |
У |
Р |
Б |
К |
С |
В
|
Яке відношення має цей вчений до теми нашого уроку ? ( коротке повідомлення про Сванте Арреніуса). Портрет на слайді .
ІV. Керована практика .
Реакції йонного обміну між розчинами електролітів відбуваються в природі навколо нас : - під час очищення питної води;
- під час очищення забруднених стічних вод хімічних підприємств;
- під час фільтрації грунтових вод;
- в сільському господарстві під час обробітку грунту для зниження кислотності грунтів;
- в організмі людини
Досить часто ви запитуєте,а що буде,якщо одну речовину змішати з іншою?Сьогодні попробуємо знайти відповідь на це запитання та з’ясуємо,за яких умов відбуваються реакції йонного обміну.Якщо відбуваються реакції між розчинами електролітів,то в розчині знаходяться не молекули,а йони.Тому реакції відбуваються між йонами.Щоб відобразити це записують не тільки молекулярні рівняння,а й йонні .
- Реакції йонного обміну – це реакції обміну між електролітами ( основами , кислотами , солями ) .
- Нерозчинні малорозчинн , газоподібні і малодисоційовані речовини записуються в молекулярному вигляді, тобто ,на йони не розпадаються .
- Сильні електроліти записуються в йонному вигляді .
- Суми електричних зарядів у лівій та правій частинах йонних рівнянь повинні бути рівними .
Демонстраційні відеодосліди :
А) Реакції з утворенням осаду :
У колбу налити розчин натрій сульфату і долити розчин барій хлориду .
Що спостерігаєте?
Запишемо рівняння реакції в молекулярній формі :
Na2SO4 + BaCI2 = 2NaCI + BaSO4↓
Реакція відбувається до кінця,тому в рівнянні біля запису формули речовини,що випадає в осад чи виділяється у вигляді газу ставлять стрілку.
Запишемо рівняння реакції в йонному вигляді,формули розчинних речовин записуємо у вигляді йонів, вказуючи їх заряд :
2Na+ + SO4 2- + Ba2+ + 2CI- = 2Na + + 2CI- + BaSO4↓
Підкреслимо знаки однакових йонів в лівій і правій частині рівнянні,тобто йонів,які не приймають участь в реакції.
Рядочком нижче запишемо йони,що залишилися.Це скорочене йонне рівняння.
SO4 2- + Ba2+ = BaSO4↓
Висновок :
Скорочене йонне рівняння вказує між якими йонами відбулася хімічна реакція .
Написати молекулярне,повне та скорочене йонне рівняння до реакцій :
1) Взаємодія аргентум нітрату з кальцій хлоридом :
AgNO3 + CaCI2 = Ca(NO3)2 + 2 AgCI ↓
2) Взаємодія натрій карбонату з кальцій нітратом :
Na2CO3 + Ca ( NO3)2 = 2NaNO3 + CaCO3 ↓
В) Взаємодія барій хлориду з калій сульфатом :
BaCI2 + K2SO4 = 2KCI + BaSO4↓
Б) Реакції з утворенням газу :
1) Взаємодія кальцій карбонату з нітратною кислотою :
Ca СО3 + 2НNO3 = Ca ( NO3)2 + СО2↑ + Н2О
2) Взаємодія натрій сульфіту з хлоридною кислотою :
Na2SO3 + 2НСІ = 2NaСІ + Н2SO3 ( Н2О + SO2 ↑ )
3) Взаємодія купрум сульфіду з хлоридною кислотою :
CuS + 2 HCI = CuCI2 + H2S ↑
В) Реакції з утворенням води :
1) Взаємодія купрум оксиду з хлоридною кислотою :
CuO + H2SO4 = CuSO4 + H2O
2) Взаємодія ферум (ІІІ) гідроксиду з хлоридною кислотою :
Fe(OH)3 + 3 HCI = FeCI3 + 3 H2O
3) Взаємодія натрій гідроксиду з нітратною кислотою :
NaOH + HNO3 = NaNO3 + H2O
Лабораторні досліди 5, 6, 7 .
Правила техніки безпеки
Ви працюватимете зі скляним посудом, розчинами лугів та кислот.
Працюємо :
- Обережно зі склом;
- Охайно;
- З невеликими кількостями речовин;
- Уважно читаємо надписи на етикетках реактивів;
- Дотримуємося правил роботи з агресивними розчинами .
- Уважно спостерігаємо за проходженням хімічної реакції.
- В роботі використовуйте таблицю розчинності солей, кислот та лугів у воді.
Користуючись інструктивною карткою виконаємо лабораторні досліди .
Інструкційна картка до лабораторних дослідів 5,6,7.
Реакції обміну між розчинами електролітів
Мета :
вивчити реакції обміну між розчинами електролітів та умови їх необоротності на прикладі реакцій,що проходять з випаданням осаду,виділенням газу,з утворенням води.
Обладнання : штатив з пробірками.
Реактиви :розчини купрум сульфату,натрій гідроксиду,натрій карбонату,хлоридної кислоти, фенолфталеїн .
І. Реакція з утворенням осаду .
1. У пробірку налийте 0,5 мл розчину купрум сульфату .
2. Додайте до нього краплями розчин натрій гідроксиду.
3. Опишіть коротко зміни,що відбуваються в пробірці .
____________________________________________________________________________
4.Запишіть рівняння хімічної реакції в молекулярному,повному та скороченому йонному вигляді :______________________________________________________________________
Висновок: з погляду теорії електролітичної дисоціації реакція відбувається до кінця , оскільки _____________________________________________________________________
ІІ. Реакція з виділенням газу .
1. У пробірку налийте 0,5 мл розчину натрій карбонату .
2. Додайте до нього краплями розчин хлоридної кислоти .
3. Опишіть коротко зміни , що відбуваються в пробірці .
____________________________________________________________________________
4.Запишіть рівняння хімічної реакції в молекулярному,повному та скороченому йонному вигляді :______________________________________________________________________
Висновок: з погляду теорії електролітичної дисоціації реакція відбувається до кінця , оскільки _____________________________________________________________________
ІІІ. Реакція з утворенням води .
1. У пробірку налийте 1 мл розчину натрій гідроксиду,додайте до нього дві краплі
фенолфталеїну .
2. До одержаного розчину додайте краплями,розмішуючи розчин,хлоридної кислоти до появи змін.
3. Опишіть коротко зміни,що відбуваються в пробірці .
____________________________________________________________________________
4.Запишіть рівняння хімічної реакції в молекулярному,повному та скороченому йонному вигляді :______________________________________________________________________
Висновок: з погляду теорії електролітичної дисоціації реакція відбувається до кінця, оскільки _____________________________________________________________________
Тестовий контроль
1.У запропонованій групі речовин усі електроліти добре дисоціюють на йони :
а) СаСІ2 , Ва( NO3)2 , ZnCI2 .
б) Cu(OH)2 , Ca(OH)2, NaOH .
2.Одночасно в розчині можуть міститися йони :
а) Na+ і ОН- ; б) Cu 2+ і ОН- ; в) К+ і СІ-
3.Для одержання карбону (ІV) оксиду треба злити розчини речовин :
а) Na2S; б) К2СО3 ; в) НСІ ; г) NaОН .
4.Встановіть відповідність :
а) катіони ; б) аніони ;
1) АІ3+ ; 2) І- ; 3) Н+ ; 4) Na+ ; 5) СО3 2- ; 6) СІ –
5.Напишіть формули речовин , що дисоціюють у водному розчині на йони : :
а) АІ3+ і NO3- ; б) Са2+ і ОН- , СІ- ; в) Na+ і СО3 2- ;
6.В якій із зазначених груп йонів знаходяться лише аніони :
а) К+ ; І- ; Mg2+ ; Ca2+ ; б) NO3- ; PO4 3- ; SO4 2- ; CI-
7.Скільки йонів утвориться при повній дисоціації сульфатної кислоти :
а) 2 ; б) 3 ; в) 4 ; г) 5 ?
8. Із кожних 200 молекул електроліту 180 розпадається на йони. Який це електроліт за силою? Наведіть розрахунки .
А) сильний електроліт; б) електроліт середньої сили ; в) слабкий електроліт .
9. Йонне рівняння Н+ + ОН- = Н2О відповідає взаємодії речовин :
а) NaОН + Ва SO4 →
б) Na2СО3 + НСІ →
в) КОН + Н NO3 →
V. Узагальнення та систематизація вивченого :
Слідство ведуть хіміки .
- При введенні у комп’ютер результатів лабораторних досліджень загубилися деякі формули речовин.Допоможіть визначити можливі варіанти,якщо частина інформації збереглася.Складіть до відновлених рівнянь повні та скорочені йонні рівняння реакцій.
1) NaOH + HCI… aCI + H2O
2) MgCI2…………….gSO3 + 2NaCI
3) K2SO3............ NO3 + H2O + SO2
4) ZnSO4 + ………….Zn(OH)2 + Na2SO4
5)AI(OH)3 +…….→ AI(NO3)3 + 3H2O
6) CaC......+ 2HCI → CaCI2 + H2O + CO2
2). Чарівник з вороном отруїв криницю.В ній був розчин хлористого кальцію,який допомагав цілому місту,тому що жителі використовували його при отруєннях,кровотечах, алергіях. Вони перетворили розчин СaCl2 в нерозчинний вапняк CaCO3.Допоможіть жителям «очистити криницю»,якщо у вашому розпорядженні є розчини NaCl, Na2CO3, HCl, H2SO4, Zn(NO3)2.
3). Оленятко спішить до друзів.Воно йшло довгих 3 дні.Йому залишилось тільки перейти річку,але вона виявилася заповнена розчином сульфатної кислоти.Допоможіть йому приєднатися до друзів,якщо у вашому розпорядженні є розчини NaCl,Ba(OH)2,HCl,CuSO4, Ba(NO3)2.
4). Тигреня та крокодил поранились,а у лікаря Айболита закінчились всі ліки. В його розпорядженні є деякі хімікати:NaNO3,Cu(OH)2,H2SO4,НCl,BaCl2.Він знає,що розчин сульфату купруму(II) може проявляти антисептичну,вяжучу,ранозагоюючу дію.Допоможіть лікарю приготувати розчин та вилікувати тигреня та крокодила .
5). Одного разу русалка помітила,що її друзі риби перестали з нею гратись та відпливають подалі від її дому.Вона не могла зрозуміти,в чому справа,адже вони не сварились…І тоді її мама розповіла їй,що риби відпливають тому, що біля їх будинку майже немає рослин і рибам не вистачає кисню…Русалка подумала,що можна посадити рослини,але вони будуть рости довго…А із старих мудрих книжок вона дізналась,що можна наситити воду вуглекислим газом – підвищення концентрації СО2 у воді приведе до значного прискорення росту рослин.В розпорядженні русалки є : NaOH,ВaCO3, K2SO4,НCl,Ba(NO3)2. Допоможіть їй добути вуглекислий газ.
6). До складу лікарського препарату « Альмагель» входить алюміній гідроксид.Складіть рівняння реакції його з хлоридною кислотою – головною складовою шлункового соку.До якого типу належить дана реакція? Запишіть рівняння в повній і скороченій йонних формах.
7). Визначте , про яку реакцію йдеться в уривку літературного твору І.Франка . Запишіть її хімічне рівняння . Класифікуйте цю реакцію за кількістю та складом реагентів і продуктів : «Шипить та куриться вапно у великих дощаних скринях»
VІ. Домашнє завдання . Вивчити § 10 вправа 93,94,95 стр. 61 скласти повні та скороченні йонні рівнянь до завдань. Підготуватись до практичної роботи №2
“Реакції йонного обміну в розчинах електролітів “ .
VІІ. Рефлексія.
Закінчи речення :
Сьогодні я дізнався…
Було цікаво…
Було складно…
Я зрозумів, що …
Тепер я можу…
Я навчився…
Я зміг…
Я спробував…
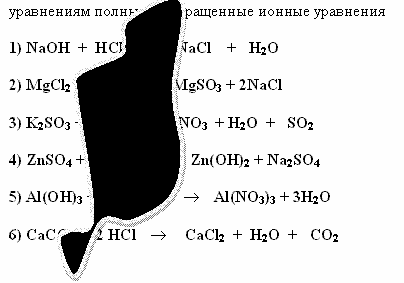


про публікацію авторської розробки
Додати розробку
