Розвязування задач з хімії "Початкові хімічні поняття"
Початкові хімічні поняття.
Практичні навички
- пояснювати відмінність поняття «хімічний елемент» від поняття «проста речовина»;
- демонструвати на прикладах відмінність хімічних сполук та механічних сумішей;
- наводити приклади елементів, що мають сталі значення валентності, та елементів, що мають змінні валентності;
- складати формули хімічних сполук за значеннями валентності елементів, які входять до складу сполуки, та вміти обчислювати значення валентності за формулою хімічної сполуки;
- розраховувати відносні молекулярні та молярні маси простих і складних речовин за їхніми формулами;
- розраховувати масові частки елементів у речовині;
- розраховувати маси речовин за відомими кількостями речовини та кількості речовин за відомими масами;
- розрахувати об’єми газів за нормальних умов та відносну густину газів;
- розраховувати, скільки атомів (молекул) міститься в певній кількості речовини.
Приклади розв’язування завдань
Задача 1: Визначте середню масу атома Хлору (у кг), якщо відомо, що маса атома Карбону-12 дорівнює 1,993 · 10-26 кг.
Дано: елемент Хлор Cl; m(12C) = 1,993 · 10-26 кг.
m(Cl) - ?
Розв’язання: 1. Визначаємо масу (в кг) атомної одиниці маси:
m(а.о.м.) = 1/12 m(12С);
m(а.о.м.) = 1/12 · 1,993 · 10-26 кг = 1,660 · 10-27 кг
2. Знаючи, що Аr(Cl) = 35,5 обчислюємо масу атома Хлору за формулою:
m(атома) = Аr(атома) · m(а.о.м.);
m(Cl) = Аr(Cl) · m(а.о.м.);
m(Cl) = 35,5 ·1,660 · 10-27 кг = 5,893 · 10-26 кг.
Відповідь: середня масса атома Хлору дорівнює 5,893 · 10-26 кг.
Задача 2: Визначте відносну молекулярну масу силікатної кислоти H2SiO3.
Дано: формула речовини H2SiO3.
Мr(H2SiO3) - ?
Розв’язання:
- Користуючись періодичною системою Д.І.Менделєєва, Знаходимо значення Аr елементів, що входять до складу силікатної кислоти: Аr(Н)=1;
Аr(Si) = 28; Аr (О) = 16.
- Визначаємо відносну молекулярну масу силікатної кислоти H2SiO3 за формулою:
Мr(молекули) = Σ Аr(Хі), де і – кількість елементів у молекулі
і
Мr(H2SiO3) = 2 · Аr (Н) + Аr (Si) + 3 · Аr (О)
Мr(H2SiO3) = 2 · 1 + 28 + 3 · 16 = 78
Відповідь: відносна молекулярна маса силікатної кислоти дорівнює 78.
Задача 3: Визначте кількість речовини міді в зразку масою 3,2 г.
Доно: m(Cu) = 3,2 г
ν(Cu) - ?
Розв’язання: 1. Відносна атомна маса Купруму дорівнює 64, отже молярна маса міді дорівнює 64 г/моль, тобто M(Cu) = 64 г/моль.
2. Визначаємо кількість речовини міді у зразку за формулою:
![]() , де Х – речовина
, де Х – речовина
![]() ;
;
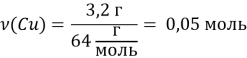
Відповідь: кількість речовини міді дорівнює 0,05 моль.
Задача 4: Визначте масу натрій хлориду NaCl, якщо кількість речовини його дорівнює 0,3 моль.
Дано: ν(NaCl) = 0,3 моль
m(NaCl) - ?
Розв’язання: 1. Визначаємо відносну молекулярну масу натрій хлориду:
Mr(NaCl) = Ar(Na) + Ar(Cl)
Mr(NaCl) = 23 + 35,5 = 58,5
Молярна маса натрій хлориду М(NaCl) = 58,5 г/моль.
2. Визначаємо масу натрій хлориду за формулою:
m(X) = ν(X) · M(X), де Х – речовина
m(NaCl) = ν(NaCl) · M(NaCl)
m(NaCl) = 0,3 моль · 58,5 г/моль = 17,55 г.
Відповідь: маса натрій хлориду дорівнює 17,55 г.
Задача 5: Визначте кількість молекул О2 в кисні масою 6,4 г.
Дано: m(O2) = 6,4 г.
N(O2) - ?
Розв’язання: 1. Враховуючи, що молярна маса кисню М(О2) = 32 г/моль, обчислюємо кількість речовини О2 за формулою:
![]() , де Х – речовина
, де Х – речовина
![]() ;
;
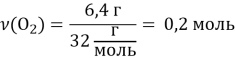
2. Визначаємо кількість молекул у речовині за формулою:
N(X) = ν(X) · NA, де Х – речовина
N(O2) = ν(O2) · NA
N(O2) = 0,2 моль · 6,02 · 1023 моль-1 = 1,204 · 1023
Відповідь: кількість молекул О2 дорівнює 1,204 · 1023.
Задача 6: Визначте масову частку калій хлориду в суміші, що містить калій хлорид масою 25 г і натрій хлорид масою 35 г.
Дано: m(KCl) = 25 г, m(NaCl) = 35 г.
w(KCl) - ?
Розв’язання: 1. Маса всієї системи (суміші) дорівнює сумі мас хлоридів калію та натрію:
m(суміші) = m(KCl) + m(NaCl)
m(суміші) = 25 г + 35 г = 60 г
2. Визначаємо масову частку калій хлориду (в частках одиниці) за формулою:
![]() , де
, де ![]() - масова частка компонента системи;
- масова частка компонента системи;
m(X) – маса цього компонента; m – маса всієї системи; або у відсотках за формулою:
![]()
![]()
![]()
Відповідь: масова частка калій хлориду в суміші дорівнює 42%.
Задача 7: Зразок мідної руди масою 150 г містить купрум(І) сульфід Cu2S та домішки, масова частка яких становить 15%. Обчисліть масу Cu2S у зразку.
Дано: m(руди) = 150 г, w(домішок) = 15% або 0,15
m(Cu2S) - ?
Розв’язання: 1. Знаходимо масу домішок у зразку руди за формулою:
m(домішок) = m(руди) · w(домішок)
m(домішок) = 150 г · 0,15 = 22,5 г.
2. Визначаємо масу купрум(І) сульфіду в зразки руди:
m(Cu2S) = m(руди) – m(домішок)
m(Cu2S) = 150 г – 22,5 г = 127,5 г.
Відповідь: маса Cu2S у зразку руди становить 127,5 г.
Задача 8: Визначте масову частку Алюмінію в алюміній оксиді Al2O3.
Дано: формула речовини Al2O3.
![]() - ?
- ?
Розв’язання: 1. Для розрахунку необхідно вибрати зразок речовини, що має певну масу або містить певну кількість речовини. Наприклад, візьмемо для розрахунку зразок алюміній оксиду, кількість речовини Al2O3 в якому дорівнює 1 моль, тобто ν(Al2O3) = 1 моль. Визначаємо масу алюміній оксиду:
m(Al2O3) = ν(Al2O3) · M(Al2O3)
m(Al2O3) = 1 моль · 102 г/моль = 102 г.
2. З формули алюміній оксиду Al2O3 випливає:
ν(Al) = 2 · ν(Al2O3)
ν(Al) = 2 · 1 моль = 2 моль.
- Визначаємо масу Алюмінію, що міститься в алюміній оксиді:
m(Al) = ν(Al) · M(Al)
m(Al) = 2 моль · 27 г/моль = 54 г
- Масова частка Алюмінію в алюміній оксиді становить:
![]()
![]()
Відповідь: масова частка Алюмінію в алюміній оксиді Al2O3 становит 53%.
Задача 9: Визначте массу хрому, яку можна добути з хром(ІІІ) оксиду Cr2O3 масою 608 г.
Дано: m(Cr2O3) = 608г
m(Cr) - ?
Розв’язання: 1. Визначаємо кількість речовини хром(ІІІ) оксиду:
![]()
![]()
2. З формули сполуки Cr2O3 випливає, що з 1 моль Cr2O3 можна добути 2 моль Cr, або
ν(Cr) = 2 · ν(Cr2O3)
ν(Cr) = 2 · 4 моль = 8 моль
3. Визначаємо масу хрому, яку можна добути з вибраного зразка хром(ІІІ) оксиду:
m(Cr) = ν(Cr) · М(Cr)
m(Cr) = 8 моль · 52 г/моль = 416 г
Відповідь: з хром(ІІІ) оксиду Cr2O3 масою 608 г можна добути 416 г хрому.
Задача 10: Відносна густина газу за повітрям дорівнює 1,517. Визначте кількість речовини цього газу, що міститься в його зразку массою 22 г.
Дано: Dпов.(Х) = 1,517; m(X) = 22 г.
ν(Х) - ?
Розв’язання: 1. Визначаємо молярну масу газу за формулою:
![]() ,
,
де Dy(X) – відносна густина газу Х з газом Y;
M(X) і M(Y) – молярні маси газів.
![]()
М(Х) = 29 г/моль · Dпов.(Х)
М(Х) = 29 г/моль · 1,517 = 44 г/моль
2. Визначаємо кількість речовини газу Х:
![]()
![]()
Відповідь: кількість речовини газу дорівнює 0,5 моль.
Задача 11: Сполука містить Натрій (масова частка 36,5%), Сульфур (25,4%0 і Оксиген (38,1%). Визначте найпростішу формулу сполуки.
Дано: сполука NaxSyOz; ω(Na) = 36,5% або 0,365;
ω(S) = 25,4% або 0,254; ω(O) = 38,1% або 0,381
NaxSyOz - ?
Розв’язання: 1. Вибираємо для розрахунків зразок речовини NaxSyOz масою 100г. Визначаємо масу Натрію, Сульфуру та Оксигену в цьому зразку:
m(Na) = m(NaxSyOz) · ω(Na)
m(Na) = 100 г · 0,365 = 36,5 г
m(S) = m(NaxSyOz) · ω(S)
m(S) = 100 г · 0,254 = 25,4 г
m(O) =m(NaxSyOz) · ω(O)
m(O) = 100 г · 0,381 = 38,1 г
2. Визначаємо кількість речовини Натрію, Сульфуру та Оксигену в цьому зразку:
![]()
![]()
![]()
![]()
![]()
![]()
3. Знаходимо співвідношення коефіцієнтів х, y та z:
x : y : z = ν(Na) : ν(S) : ν(O) = 1,6 : 0,8 : 2,4
Поділивши праву частину рівності на найменше число (0,8), маємо:
x : y : z = 2 : 1 : 3
Отже, найпростіша формула сполуки Na2SO3.
Відповідь: найпростіша формула сполуки Na2SO3.
Виконайте
- Визначте число атомів кожного з елементів, які містяться в 1,5 л вуглекислого газу (н.у.).
- Змішали порошкоподібні метали: цинк масою 25 г, мідь масою 30 г і залізо масою 45 г. Визначте масову частку міді в отриманій суміші.
- Визначте масові частки елементів у нітратній кислоті HNO3.
- Визначте масові частки елементів у калій силікаті K2SiO3.
- У якій сполуці масова частка Купруму більша: курпум(ІІ) оксид CuO чи купрум(І) оксиді Cu2O? Відповідь підтвердіть розрахунками.
- У якій сполуці масова частка Оксигену більша: нітроген(ІІ) оксиді NO чи нітроген(IV) оксиді NO2? Відповідь підтвердіть розрахунками.
- Кількість речовини калій оксиду К2О дорівнює 0,5 моль. Визначте масу кисню, необхідного для отримання цього зразка оксиду.
- Кількість речовини натрій карбонату Na2CO3 дорівнює 0,8 моль. Визначте масу натрію, необхідного для отримання цього зразка карбонату.
- Визначте відносну густину амоніаку за киснем та повітрям.
10.Визначте відносну густину вуглекислого газу за повітрям та воднем.
11.Визначте молярну масу газу, густина якого за воднем дорівнює 35.5.
12.Визначте масу 1 л (н.у.) таких газів: а) азоту N2; б) метану СН4;
в) кисню О2; г) чадного газу СО.
13.Визначте формулу речовини, якщо відомі масові частки елементів, що складають цю молекулу: ω(Cl) = 92,21%, все інше становить Карбон.
14.Масові частки Феруму та Сульфуру в сполуці дорівнюють 46,67% та 53,33%. Визначте формулу сполуки.
15.Масові частки Натрію, Фосфору та Оксигену в сполуці дорівнюють 34,59%, 23,31% та 42,15%. Визначте формулу сполуки.
16.Нітроген утворює оксид, відносна густина якого за Гелієм дорівнює 19, а масова частка Оксигену 63,16%. Визначте формулу оксиду.
17.Масові частки Натрію, Силіцію та Оксигену в сполуці дорівнюють 37,71%, 22,95% та 39,34%. Визначте формулу сполуки.


про публікацію авторської розробки
Додати розробку
