Використання алгоритмів при розв’язуванні хімічних завдань
Відділ освіти Яворівської райдержадміністрації
Методичний кабінет
Л.Б.Кульматицька
Методичний посібник для вчителів та учнів
Використання алгоритмів при розв’язуванні хімічних завдань
Яворів - 2011
У посібнику вміщені алгоритмічні приписи для розв’язування розрахункових завдань у шкільному курсі хімії Даний посібник допоможе вчителям організувати навчальний процес на уроках хімії у такий спосіб, щоб активність учнів була якнайбільшою, щоби мали місце індивідуальний підхід до кожної дитини та диференціація навчальної роботи школярів.
Учні та абітурієнти можуть використати даний матеріал для самостійного навчання.
Рекомендовано до друку радою методичного кабінету
Протокол №1 від 25 січня 2011 року
Підготувала:
Кульматицька Л.Б. – вчитель хімії СЗШ І – ІІІ ст.
ім. Р.Шухевича смт. Краковець
Рецензент:
Фітьо Я.А. – методист хімії райметодкабінету
Яворівської райдержадміністрації
Макетування:
Мазяр К.С. – вчитель інформатики СЗШ І – ІІІ
ст. ім. Р.Шухевича смт. Краковець
Відповідальна
за випуск:
Фірчук О.М. – завідувач райметодкабінетом
Передмова
Поняття «алгоритм» прийшло у хімію з математики. Воно походить від імені перського вченого, астронома та математика Аль-Хорезмі (825 рік до н.е.). Алгоритм – це опис процесу вирішення того чи іншого завдання. Алго-
ритмом називається кінцевий набір правил, розташованих в певному поряд-
ку, що дозволяє виконавцю вирішувати будь-яку конкретну задачу з деякого класу однотипних задач («Український педагогічний словник»).
Застосовувати алгоритми можна в двох випадках. По-перше, з метою формування в учнів певних прийомів пізнавальної діяльності ( мислення, пам’ять, увагу ). Тут вони виступають як основна складова змісту навчання. По-друге , для формування практичних вмінь та навичок. У цьому разі алгоритми є засобом навчання.
Можливість і необхідність застосування алгоритмів у навчанні зумовлені не лише тим, що алгоритмічним шляхом матеріал засвоюється швидше, а й тим, що учням доводиться розв’язувати багато задач, тож оволодіння чіткою послідовністю розв’язування конкретного класу задач допомагає швидше спланувати методику розв’язання.
У хімії вводиться нове поняття «алгоритмічний припис», який на відміну від математичного алгоритму менш формалізований, оскільки допускає операції не тільки з об’єктами знакової природи, а й потребує розумових операцій, застосування специфічних способів діяльності.
З урахуванням результатів аналізу літературних джерел, з питань їх використання у навчанні пропоную алгоритмічні приписи з хімії для розв’язування основних типів задач та вправ в курсі хімії для 7 – 11 класів.
Запропоновані алгоритмічні приписи містять: а) основні хімічні поняття, на яких побудований алгоритмічний припис і які потрібно учню для використання конкретних дій згідно з алгоритмом; б) послідовність виконання дій; в) зразки розв’язків розрахункових завдань.
Обчислення відносної молекулярної маси речовини.
Що траба знати та вміти:
- Відносна молекулярна маса речовини Mr чисельно дорівнює сумі відносних атомних мас усіх атомів, що входять до складу молекули речовини.
- Вміти записувати формули речовин.
- Робити математичні обчислення.
Приклад завдання. Обчисліть відносну молекулярну масу сульфатної кислоти (H2SO4).
|
Порядок виконання |
Розв’язання |
|
1. Аналізуємо задачу і записуємо скорочену умову.
2. Знаходимо відносну молекулярну масу сполуки.
3. Записуємо відповідь. |
H2SO4
Mr - ?
Mr(H2SO4) = 2Ar(H) + Ar(S) + 4 Ar(O) = 2 ∙ 1 + 32 + 4 ∙ 16 = 98
Відповідь: Mr(H2SO4) = 98. |
Обчислення відношення мас елементів у складній речовині.
Що треба знати та вміти:
- Маси елементів у складній речовині відносяться між собою як їх атомні маси помножені на число атомів кожного елемента.
- Виконувати математичні обчислення.
Приклад завдання. Обчислити відношення мас елементів у кальцій карбонаті (CaCO3).
|
Порядок виконання |
Розв’язання |
|
1.Аналізуємо задачу й записуємо скорочену умову.
2.Обчислюємо відношення мас елементів за формулою.
3.Одержане відношення скорочуємо, поділивши всі члени нa найбільший спільний дільник . 4.Записуємо відповідь. |
CaCO3
m(Ca): m(C):m(O) - ?
m(Ca): m(C):m(O) = Ar(Ca) : Ar(C) : 3Ar(O) = 40 : 12 : 3 ∙ 16 = 40 : 12 : 48 = Скорочуємо на 4 = 10 : 3 : 12.
Відповідь: m(Ca): m(C):m(O) = 10 : 3 : 12. |
Обчислення маси елемента за відомою масою речовини.
Що треба знати та вміти:
- Складати та розв’язувати математичні пропорції.
- Обчислювати відносну молекулярну масу речовини.
3. Молярна маса M – чисельно дорівнює відносній молекулярній масі
-
Обчислювати кількість речовини:
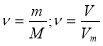
Приклад завдання. Обчислити масу елемента Фосфору, який міститься в 620 г кальцій фосфату.
|
Порядок виконання |
Розв’язання |
|
1. Аналізуємо задачу та робимо скорочений запис умови
2 . Записуємо атомну масу елемента та обчислюємо молекулярну масу даної речовини.
3.Записуємо проропорцію та обчислюємо невідоме.
4. Записуємо відповідь.
ІІ спосіб 1. Аналізуємо задачу та робимо скорочений запис умови
2. Обчислюємо молярні маси елемента та речовини.
3.Обчислюємо кількість молів даної речовини.
4.Обчислюємо кількість речовини елемента.
5.Знаходимо масу елемента.
6.Записуємо відповідь. |
Дано: m(Ca3(PO4)2)=620г
m(P) - ?
Mr(Ca3(PO4)2) = 120 + 62 + 128 = 310 Ar (P) = 31
З10 г Ca3(PO4)2 містить 62г Р
Відповідь: m(P) = 124 г.
m(Ca3(PO)4)=620г
m(P) - ?
Відповідь: маса Фосфору 124 г.
|
Обчислення масової частки елемента у складній речовині за її формулою.
Що треба знати та вміти:
- Як обчислювати відносну молекулярну масу сполуки.
-
Формулу для визначення масової частки елемента у сполуці
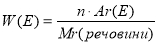
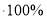 , де
, де 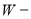 масова частка елемента;
масова частка елемента;
![]() індекс;
індекс; ![]() атомна маса елемента;
атомна маса елемента;![]() молекулярна маса речовини.
молекулярна маса речовини.
Приклад завдання. Обчислити масову частку Алюмінію в алюміній оксиді.
|
Порядок виконання |
Розв’язання |
|
1.Аналізуємо задачу та робимо скорочений запис умови.
2.Знаходимо відносну молекулярну масу речовини.
3.Записуємо дані у формулу, за якою знаходимо масову частку елемента.
4.Обчислюємо задану в умові задачі масову частку.
5.Записуємо відповідь.
|
Дано:
Відповідь: |
Виведення найпростіших формул речовин за масовими частками елементів.
Що треба знати та вміти:
1. Формулу для обчислення масової частки елемента в речовині.
![]()
![]()
2. Обчислювати відносну молекуляру масу речовини.
3. Виконувати математичні дії.
Приклад завдання. Визначте молекулярну формулу речовини, якщо масові частки елементів у ній складають Sr – 47,83%; S – 17,39%; O – 34,78%
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та запис скороченої умови.
2.Позначення числа атомів кожного елемента, що входить до складу речовини через невідомі:
3.Знаходження відношення:
4.Приведення одержаних даних до найменших цілих чисел, шляхом ділення всіх членів відношення на найменше з них.
5.Записуємо відповідь.
|
SrxSyOz
Одержаний результат ділимо почергово на 0,54 (найменше число відношення) і отримуємо результат
Відповідь: формула речовини SrSO4.
|
Виведення формули хімічної сполуки за масовими частками елементів та відносною густиною .
Що треба знати:
1. Обчислення відносної молекулярної маси речовини.
2. Формулу масової частки елемента у речовині: ![]()
![]()
3. Формулу відносної густини газів:![]() .
.
Приклад завдання: Виведіть молекулярну формулу вуглеводню, в якому масові частки елементів: С - 80,0%; Н – 20,0%. Відносна густина його за воднем дорівнює 15.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та запис скороченої умови.
2.Позначення числа атомів кожного елемента, що входить до складу речовини через невідомі
3.Знаходження відношення:
4.Приведення одержаних даних до найменших цілих чисел, шляхом ділення вісіх членів відношення на найменше з них.
5.Запис найпростішої формули.
6.Обчислення відносної молекулярної маси речовини за найпростішою формулою.
7.Обчислення відносної молекулярної маси невідомої речовини за відносною густиною.
8.Знаходження відношення молекулярної маси невідомої речовини до молекулярної маси цієї речовини, обчисленої за найпростішою формулою.
9.Виводимо формулу речовини, помноживши найпростішу формулу на одержаний множник n.
10.Записуємо відповідь. |
Формула - ?
Ділимо обидва члени відношення на 6,6:
Найпростіша формула СН3;
Mr(CxHy)=
Індекси найпростішої формули треба подвоїти.
Виводимо формулу 2СН3
Відповідь: молекулярна формула С2Н6 . |
![]() Обчислення молекулярної формули речовини за відносною густиною і масою (об’ємом) продуктів її згоряння.
Обчислення молекулярної формули речовини за відносною густиною і масою (об’ємом) продуктів її згоряння.
Що треба знати та вміти:
- Обчислювати молярну масу речовини за її відносною густиною.
- Обчислення кількості речовини за її масою та об’ємом і навпаки.
Приклад завдання. Під час спалювання речовини масою 4,6 г утворився карбон (ІV) оксид масою 8,8 г і вода масою 5,4 г. Густина пари речовини за повітрям дорівнює 1,59. Виведіть молекулярну формулу речовини.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Обчислюємо молярну масу органічної сполуки за відносною густиною. 3.Обчислюємо кількість речовини вуглекислого газу.
4.Розраховуємо кількість речовини і масу Карбону, що входить до складу речовини.
5.Обчислюємо кількість речовини води.
6.Розраховуємо кількість речовини і масу атомів Гідрогену.
7.Визначаємо наявність Оксигену у сполуці і обчислюємо кількість речовини Оксигену.
8.Записуємо кількісне відношення елементів і виводимо найпростішу формулу сполуки.
9.Обчислюємо її молярну масу.
10.Встановлюємо молекулярну формулу органічної сполуки.
11.Записуємо відповідь. |
Дано: m(CxHyOz) =46 г V(CO2) =44,8 л m(H2O) =54 г Dповітря-1,59
CxHyOz - ?
Найпростіша формула – С2Н6О
М(С2Н6О)=12∙2+1∙6+16=46г/моль
Індекси найпростішої формули не змінюються, отже молекулярна формула сполуки – С2Н6О
Відповідь: молекулярна формула сполуки С2Н5ОН – етанол. |
Обчислення відносної густини газів.
Що треба знати та віміти:
1. Обчислення відносної молекулярної маси речовин.
2. Формулу для обчислення відносної густини одного газу за іншим:
![]()
де D2 – відносна густина першого газу за другим; Mr1, Mr2 – відповідно
молекулярні маси газів.
- Виконувати математичні обчислення.
Приклад завдання: обчислити відносну густину метану за воднем.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та запис скороченої умови.
2.Записуємо формулу для обчислення відносної густини одного газу за іншим.
3.Обчислюємо відносні молекулярні маси речовин.
4.Одержані значення відносних молекулярних мас підставляємо у формулу для обчислення відносної густини.
5.Записуємо відповідь. |
Дано: СН4
Відповідь: відносна густина метану за воднем становить 8.
|
Обчислення кількості структурних частинок (молекул, атомів, йонів) за кількістю речовини.
Що треба знати та вміти:
- Число Авогадро: NA=6,02∙1023моль-1.
- Формулу для обчислення кількості речовини за числом структурних частинок і похідні від неї формули:
![]()
де ![]() -кількість речовини;
-кількість речовини; ![]() - кількість структурних частинок цієї
- кількість структурних частинок цієї
речовини.
3. Виконувати математичні обчислення.
Приклад завдання. Скільки атомів міститься в 3 моль міді?
|
Порядок виконання |
Розв’язання |
|
1. Аналіз задачі та скорочений запис її умови.
2.Записуємо формулу для обчислення кількості структурних частинок за кількістю речовини.
3.Підставляємо значення у формулу і робимо обчислення.
4.Записуємо відповідь. |
Відповідь: 18,06∙1023 атомів. |
Приклад завдання. Яка кількість молекул озону та атомів Оксигену міститься в 0,5 моль озону?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо формулу для обчислення кількості структурних частинок за кількістю речовини.
3.Підставляємо значення у формулу і робимо обчислення кількості молекул.
4.Обчислюємо кількість атомів Оксигену .
5.Записуємо відповідь. |
Дано:
Враховуючи,що в одній молекулі озону міститься 3 атоми Оксигену, одержуємо:
Відповідь: 3,01∙23 молекул озону та 9,03∙1023 атомів Оксигену. |
Обчислення, пов’язані з використанням поняття «молярна маса».
Що траба знати та вміти:
1. Обчислювати молярну масу речовини.
2. Формулу для обчислення кількості речовини за іі масою та похідні від неї
формули: ![]()
де ![]() кількість речовини (моль, кмоль);
кількість речовини (моль, кмоль); ![]() маса заданої порції речовини
маса заданої порції речовини
(г, кг); ![]() молярна маса речовини (г/моль, кг/моль).
молярна маса речовини (г/моль, кг/моль).
3. Виконувати математичні обчислення.
Приклад завдання. Обчислити масу натрій сульфату кількістю речовини 2,5 моль.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо формулу для обчислення маси речовини за її кількістю.
3.Обчислюємо молярну масу даної речовини.
4.Підставляємо одержане значення у формулу і обчислюємо масу речовини.
5.Записуємо відповідь. |
Дано:
Відповідь: маса натрій сульфату становить 355 г. |
Приклад завдання. Обчислити кількість речовини манган (ІV) оксиду масою 130,5 г.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо формулу для обчислення кількості речовини за її масою.
3.Обчислюємо молярну масу даної речовини.
4.Підставляємо одержане значення у формулу і знаходимо кількість речовини.
5.Записуємо відповідь: |
Дано:
Відповідь: кількість речовини манган (ІV) оксиду 1,5 моль. |
![]() Обчислення, пов’язані з використанням поняття “молярний об’єм газу”.
Обчислення, пов’язані з використанням поняття “молярний об’єм газу”.
Що треба знати та вміти:
- Закон Авогадро та наслідки до нього.
- Які умови називають нормальними?
- Формулу для обчислення кількості газуватої речовини за її об’ємом та похідні від неї формули:
![]()
![]() ,
,
де ![]() - кількість речовини (моль, кмоль),
- кількість речовини (моль, кмоль), ![]() - об’єм газу (л),
- об’єм газу (л), ![]() -
-
молярний об’єм газу ( при н.у. =22,4 л/моль)
3. Виконувати математичні обчислення.
Приклад завдання. Обчислити об’єм (н.у.) етану кількістю речовини 0,25 моль.
|
Порядок виконання |
Розв’язання |
|
1.Аналізуємо задачу та робимо скорочений запис умови.
2.Виводимо формулу для обчислення об’єму газу за кількістю речовини (н.у.)
3.Підставляємо величини у формулу, враховуючи значення молярного об’єму газів.
4.Записуємо відповідь. |
Дано:
Відповідь: об’єм етану 5,6 л. |
Приклад завдання. Обчислити кількість речовини карбон (ІV) оксиду об’ємом 112л (н.у.)
|
Порядок виконання |
Розв’язання |
|
1.Аналізуємо задачу та робимо скорочений запис умови.
2.Записуємо формулу для обчислення кількості речовини за об’ємом газу (н.у.)
3.Підставляємо величини у формулу, враховуючи значення молярного об’єму газів.
4.Записуємо відповідь. |
Дано:
Відповідь: кількість речовини етану 0,25 моль |
Обчислення, пов’язані з використанням закону об’ємних відношень газів при хімічних реакціях.
Що треба знати і вміти:
- Коефіцієнти в рівнянні реакції вказують на мольне співвідношення між реагуючими речовинами та продуктами реакції.
- Закон об’ємних відношень Гей-Люссака: об’єми газів, що вступають у реакцію за одинакових умов, відносяться між собою як прості цілі числа (коефіцієнти у рівнянні реакції).
![]()
![]() Нехай А, В і АВ – газоподібні речовини у рівнянні А + В = АВ, тоді
Нехай А, В і АВ – газоподібні речовини у рівнянні А + В = АВ, тоді
![]()
3.Складання пропорцій, виконання математичних дій.
Приклад завдання. Який об’єм кисню потрібен для спалювання гідроген сульфіду об’ємом 1 м3?
![]()
|
Порядок виконання |
Розв’язання |
|
1.Аналізуємо задачу та записуємо скорочену умову.
2.Записуємо рівняння хімічної реакції та врівнюємо його.
3.Над формулами речовин у рівнянні записуємо задані значення і ті, які потрібно знайти.
4.Під формулами вказуємо об’ємні відношення газів згідно рівняння реакції.
5.Складаємо пропорцію.
6.Обчислюємо невідоме.
7.Записуємо відповідь. |
V(H2S)=1м3
V(O2) - ?
2H2S + 3O2 = 2H2O + 2SO2
1м3 х 2H2S + 3O2 = 2H2O + 2SO2 2м3 3м3
Відповідь: об’єм кисню 1,5 м3.
|
Складання хімічних формул за валентністю хімічних елементів.
Що треба знати та вміти:
- Символи хімічних елементів.
- Визначення поняття «валентність».
- Хімічні елементи зі сталою валентністю.
- Правило: сума валентностей одного хімічного елемента, в бінарній сполуці дорівнює сумі валентностей іншого елемента.
- Знаходити найменше спільне кратне двох чисел.
Приклад завдання. Складіть формулу ферум (ІІІ) оксиду.
|
Порядок виконання |
Розв’язання |
|
1.Аналізуємо умову завдання.
2.Записуємо символи хімічних елементів.
3.Записуємо валентності елементів у сполуці.
4.Знаходимо найменше спільне кратне для чисел, що відповідають валентності елемента.
5.Одержане число ділимо послідовно на валентність кожного елемента.
6.Частки від ділення проставляємо у вигляді індексів біля символів хімічних елементів. |
До складу сполуки входять два хімічних елементи Ферум та Оксиген.
FeO
ІІІ ІІ FeO
3∙2=6 ІІІ ІІ Fe O
6:3=2; 6:2=3
Fe2O3
|
Подібний алгоритм можна застосовувати для складання формул кислот, основ, солей.
Приклад завдання. Визначити валентність атома Сульфуру у його сполуці з Оксигеном, формула якої SO3.
|
Порядок виконання |
Розв’язання |
|
1.Аналізуємо умову завдання, записуємо хімічну формулу речовини і позначаємо відому валентність елемента.
2.Знаходимо і записуюємо загальну кількість одиниць валентності (найменше спільне кратне) цього елемента.
3.Обчислюємо валентність елемента, поділивши найменше спільне кратне на індекс елемента.
4.Одержане число записуємо над хімічним символом елемента. |
II S O3
Кількість атомів Оксигену множимо на його валентність: 2∙3=6 – найменше спільне кратне
6:1=6 - валентність атома Сульфуру
VI II S O3 |
Врівнювання рівнянь хімічних реакцій шляхом математичного підбору коефіцієнтів.
Що треба знати та вміти:
- Хімічні рівняння записують за допомогою хімічних формул та коефіцієнтів.
- Коефіцієнт – множник, який ставиться перед формулою речовини.
- У кожному рівнянні є дві частини, сполучені знаком «дорівнює». У лівій частині записують формули речовин, що вступають в реакцію, у правій – формули речовин, що утворюються внаслідок реакції.
- Закон збереження маси: «Маси речовин, що вступають в хімічну реакцію дорівнюють масі речовин, які утворюються внаслідок хімічної реакції».
- Число атомів кожного елемента в лівій і правій частинах рівняння повинно бути однаковим.
Приклад завдання. Скласти рівняння реакції взаємодії ферум (ІІІ) хлориду з натрій гідроксидом.
|
Порядок виконання |
Розв’язання |
|
1.Спочатку запишемо схему реакції, тобто формули вихідних і кінцевих речовин реакції, зазначивши стрілкою її напрям.
2.Послідовно проводимо порівняння кількостей атомів кожного хімічного елемента у лівій і правій частині схеми та визначаємо, які коефіцієнти слід поставити перед формулами речовин.
3.Записуємо рівняння реакції. |
FeCl3 + NaOH → Fe(OH)3 + NaCl
Щоб зрівняти число атомів Феруму, Натрію, Хлору, Оксигену та Гідрогену в лівій і правій частинах рівняння, слід перед формулами NaCl і NaOH поставити коефіцієнти 3:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl.
У цьому рівнянні число атомів кожного елемента у лівій частині дорівнює числу таких самих атомів у правій частині. Це означає, що закон збереження маси задовольняється цим рівнянням. |
Складання рівнянь окисно-відновних реакцій.
Що треба знати та вміти:
- Правила визначення ступенів окиснення елементів у речовині.
- Окисник – атом, який приймає електрони, відновник – віддає; окиснення – процес приєднання електронів, відновлення – приєднання.
- Знаходити найменше спільне кратне.
- Врівнювати рівняння хімічних реакцій шляхом математичного підбору.
Приклад завдання. Напишіть рівняння реакції одержання хлору при взаємодії концентрованої хлоридної кислоти і манган (ІV) оксиду. Складіть схему електронного балансу, вкажіть окисник і відновник.
|
Порядок виконання |
Розв’язання |
|
1.Записуємо формули вихідних речовин і продуктів реакції у схему рівняння реакції.
2.Позначаємо над символами атомів ступені окиснення елементів.
3.Складаємо електронні рівняння віддачі та приєднання електронів; знаходимо коефіцієнти при окиснику і відновнику поділивши найменше спільне кратне між прийнятими і відданими електронами.
5.Одержані числа це коефіцієнти окисника і відновника, ставимо їх у рівнянні реакції.
6.Після чого шляхом математичного підбору ставляться коефіцієнти перед формулами інших речовин.
|
HCl + MnO2 = Cl2 + MnCl2 + H2O
H+1Cl-1+Mn+4O2-2→Cl20+Mn+2Cl2-1+H2+1O-2
окиснюється 1
Mn+4+2e-→Mn+2 1 – окисник – відновлюєтьс
В даному випадку вони рівні 2 і 1. Коефіцієнт 2 ставиться тому, що 2 електрони віддають 2 атоми Хлору з ступенем окиснення -1.
2HCl + MnO2 → Cl2 + MnCl2 + H2O
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O. |
Розв’язування розрахункових задач на обчислення за хімічними рівняннями.
Що треба знати та вміти:
- Поняття: відносна молекулярна маса, молярна маса, моль, молярний об’єм та формули, що пов’язують ці величини:
![]()
![]() ;
;
де ![]() кількість речовини;
кількість речовини; ![]() маса;
маса; ![]() молярна маса речовини;
молярна маса речовини; ![]()
об'єм газу; ![]() молярний об’єм газу при нормальних
молярний об’єм газу при нормальних
умовах.
- Коефіцієнти в рівнянні реакції вказують на мольне співвідношення між реагуючими речовинами та продуктами реакції.
- Складати рівняння хімічних реакцій.
- Складати та розв’язувати пропорції.
- Виконувати математичні дії.
Приклад завдання. Залізо кількістю речовини 0,6 моль окиснили. Яка кількість речовини кисню витратилася при цьому?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо рівняння реакції та врівнюємо його.
3.Записуємо над формулами задані значення і ті, які потрібно знайти. Під формулами заданих речовин записуємо їх мольне співвідношення згідно рівняння реакції.
4.Складаємо пропорцію.
5.Обчислюємо невідоме.
6.Записуємо відповідь.
|
3Fe + 2O2 = Fe3O4
0,6моль х 3Fe + 2O2 = Fe3O4 3моль 2моль
Відповідь: кількість речовини кисню дорівнює 0,4 моль. |
Приклад завдання. Обчислити масу натрій гідроксиду потрібну на нейтралізацію 0,2 моль сульфатної кислоти.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо рівняння реакції та врівнюємо його. . 3.Обчислюємо молярну масу натрій гідроксиду.
4.Записуємо над формулами задані значення і ті, які потрібно знайти. Під формулами заданих речовин записуємо їх мольне та масове співвідношення згідно рівняння реакції.
4.Складаємо пропорцію.
5.Обчислюємо невідоме.
6.Записуємо відповідь.
|
2NaOH + H2SO4 = Na2SO4 + 2H2O
М(NaOH) = 40 г/моль
х 0,2моль 2NaOH + H2SO4 = Na2SO4 + 2H2O 80г 1моль
Відповідь: маса натрій гідроксиду дорівнює 1,6 г. |
Приклад завдання. На нейтралізацію нітратної кислоти витратили кальцій гідроксид масою 11,1 г. Яка маса кислоти при цьому витратилася?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо рівняння реакції та врівнюємо його.
3.Обчислюємо молярні маси заданих речовин.
4.Записуємо над формулами задані значення і ті, які потрібно знайти. Під формулами заданих речовин записуємо їх масове співвідношення згідно рівняння реакції.
4.Складаємо пропорцію.
5.Обчислюємо невідоме.
6.Записуємо відповідь.
|
11,1г х Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O 74г 126г
Відповідь: маса нітратної кислоти 18,9г. |
Приклад завдання. У надлишку хлоридної кислоти розчинили магній масою 6 г. Який об’єм водню, виміряний за нормальних умов, виділиться при цьому?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо рівняння реакції та врівнюємо його.
3.Обчислюємо молярні маси заданих речовин.
4.Записуємо над формулами задані значення і ті, які потрібно знайти. Під формулами заданих речовин записуємо їх масове та об’ємне співвідношення згідно рівняння реакції.
4.Складаємо пропорцію.
5.Обчислюємо невідоме.
6.Записуємо відповідь. |
Дано:
Mg + 2HCl = MgCl2 + H2↑
M(Mg) = 24г/моль
6г х Mg + 2HCl = MgCl2 + H2↑ 24г 22,4л
Відповідь: об’єм водню 5,6 л. |
Приклад завдання. Внаслідок взаємодії з водою одновалентного металу ма- сою 19,5 г виділяється водень об’ємом 5,6 л (н.у.). Визначити цей метал.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо рівняння реакції та врівнюємо його.
3.Обчислюємо молярні маси заданих речовин.
4.Записуємо над формулами задані значення і ті, які потрібно знайти. Під формулами заданих речовин записуємо їх масове та об’ємне співвідношення згідно рівняння реакції.
4.Складаємо пропорцію.
5.Обчислюємо невідоме.
6.Записуємо відповідь.
|
Дано:
Е - ?
2E + 2H2O = 2EOH + H2↑
M(E) = x г/моль
19,5г 5,6л 2E + 2H2O = 2EOH + H2↑ 2хг 22,4л
отже метал – Калій
Відповідь: Калій. |
Обчислення масової частки і маси речовини в розчині.
Що треба вміти та знати:
- Компонентами розчину є розчинник та розчинена речовина, тому маса розчину складається з мас цих двох компонентів:
m(розчину)=m( речовини) + m(розчинника).
- Масова частка розчиненої речовини W – це відношення маси розчиненої речовини до маси розчину:
![]() .
.
де m(речовини) – маса розчиненої речовини в розчині;
m(розчину) – маса розчину.
3. Формулу, що пов’язує густину, масу та об’єм розчину:![]() ,
,
де ρ –густина розчину; m – маса розчину; V – об’єм розчину.
4. Одиниці вимірювання об’єму, густини, маси.
5. Виконувати математичні дії.
Приклад завдання. Натрій хлорид масою 7 г розчинили у воді масою
193 г. Яка масова частка натрій хлориду в одержаному розині?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Обчислюємо масу розчину.
3.Записуємо формулу для обчислення масової частки речовини в розчині.
4.Підставляємо чисельні дані у формулу і робимо обчислення.
5.Записуємо відповідь. |
Дано:
Відповідь: масова частка натрій хлориду в розчині становить 3,5%. |
Приклад завдання. Які маси натрій карбонату і води слід взяти, щоб приготувати розчин масою 50 г з масовою часткою солі 5%?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо формулу для обчислення маси речовини за відомою масовою часткою.
3.Підставляємо значення у формулу і робимо обчислення.
4.Записуємо формулу для обчислення маси води.
5.Підставляємо чисельні значення у формулу і робимо обчислення.
6.Записуємо відповідь. |
Дано: m(розчину)=50 г
W(Na2CO3)=5%
m(Na2CO3) - ? m(H2O) -?
Відповідь: маса натрій карбонату і води відповідно складають 2,5 г і 47,5г. |
Приклад завдання. У воді об’ємом 200 мл розчинили сіль масою 40 г. Визначте масову частку солі у добутому розчині, прийнявши густину води такою, що дорівнює 1 г/мл.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Визначаємо масу розчинника (води).
3.Обчислюємо масу розчину.
4.Підставляємо чисельні дані у формулу масової частки.
5.Записуємо відповідь. |
V(H2O)=200 мл m(солі)=40 г ρ(H2O)=1 г/мл
W(солі) - ?
Відповідь: масова частка солі 16,7%. |
Приклад завдання. Обчислити масову частку речовини в розчині, одержаному змішуванням 100 г розчину з масовою часткою розчиненої речовини 20% і 50 г розчину з масовою часткою речовини 32%.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Обчислюємо масу речовини у першому розчині.
3.Обчислюємо масу речовини у другому розчині.
4.Знаходимо масу речовини у третьому розчині.
5.Обчислюємо масу третього розчину.
6.Одержані значення підставляємо у формулу для обчислення масової частки речовини у третьому розчині.
7.Записуємо відповідь. |
m1(розчину)=100 г W1=20% m(розчину)=50 г W2=32%
W3 - ?
Відповідь: масова частка розчиненої речовини в одержаному розчині 24%. |
Обчислення маси або об’єму продукту реакції за відомою масою або об’ємом вихідної речовини, що містить домішки.
Що треба знати і вміти:
- На хімічних виробництвах використовують сировину, яка не завжди є чистою речовиною, а може містити домішки..
- Домішки не будуть утворювати необхідні продукти, тому перед розрахунком за хімічним рівнянням необхідно розрахувати масу або об’єм чистої речовини, яка міститься в сировинній суміші.
- Масову частку чистої речовини в суміші обчислюють за формулою:
![]()
Приклад завдання. Який об’єм вуглекислого газу (н.у.) виділиться, якщо 15 г натрій карбонату з масовою часткою некарбонатних домішок 10% розчинити у хлоридній кислоті?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Обчислюємо масову частку чистої речовини у суміші.
3.За формулою обчислюємо масу чистої речовини в суміші.
4.Записуємо рівняння реакції і врівнюємо його.
5.Обчислюємо молярні маси речовин; над формулами речо- вин записуємо задані величи- ни, а під формулами масові та об’ємні співвідношення за рівнянням реакції. 7.Складаємо пропорцію і обчислюємо невідоме.
8.Записуємо відповідь. |
Дано:
13,5 г х Na2CO3 + 2HCl = 2NaCl + CO2 + H2O 106 г 22,4 л
М(Na2CO3) = 106 г/моль
Відповідь: об’єм вуглекислого газу 2,85 л. |
Приклад завдання. Мідь масою 54,5 г, що містить домішки купрум (ІІ) оксиду, помістили в надлишок концентрованої сульфатної кислоти. Виділилось 17,92 л газу (н.у.). Визначте масову частку домішок купрум (ІІ) оксиду в міді.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записуємо рівняння реакції і врівнюємо його.
3.За кількістю виділеного газу розраховуємо масу вихідної ре- човини, що вступила в реакцію.
4.Складаємо пропорцію і обчислюємо невідоме.
5.Обчислюємо масову частку чистої речовини.
6.Знаходимо масову частку домішок.
7.Записуємо відповідь. |
Дано: m(Cu+CuO)=54,5 г V(SO2)=17,92л
W(CuO) - ?
х 17,92л Cu + 2H2SO4(конц.) = CuSO4 + SO2 ↑+ 2H2O 64г 22,4л
M(Cu)=64 г/моль
Відповідь: масова частка домішок купрум (ІІ) оксиду становить 6%. |
Обчислення за рівняннями хімічних реакцій, якщо один із реагентів взято у надлишку.
Що треба знати і вміти:
- Поняття моль, молярна маса, молярний об’єм, відносна молекулярна маса, формули:
![]()
![]()
- Коефіцієнти в рівнянні реакції вказують на мольне співвідношення між речовинами.
- Розв’язувати задачі на розрахунки за хімічними рівняннями.
- Складати рівняння хімічних реакцій.
- Виконувати математичні дії, розв’язувати пропорції.
Приклад завдання. Кальцій оксид масою 6 г піддали дії сульфатної кислоти масою 9,8 г. Яка маса солі утворилася?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз умови задачі та скоро- чений запис її умови.
2.Записуємо рівняння реакції та врівнюємо його.
3.Визначаємо мольне співвідношення між взятими речовинами за рівнянням реакції.
4.Обчислюємо молярні маси заданих речовин.
5.Знаходимо кількість молів заданих речовин.
.З’ясовуємо. котру з речовин взято в надлишку.
7.Розв’язуємо задачу на розрахунок за хімічним рівнянням, виходячи з мольного співвідношення речовин, які повністю прореагували.
8.Записуємо відповідь. |
Дано: m(СaO)=6 г m(H2SO4)=9,8 г
m(CaSO4)-?
CaO + H2SO4 = CaSO4 + H2O
(СaO): (H2SO4)=1 : 1
M(CaO)=56 г/моль; M(CaSO4)=136г; M(H2SO4)=98 г/моль
За умовою (СaO): (H2SO4)=0,11 : 0,1, отже у надлишку СаО
9,8 г х CaO + H2SO4 = CaSO4 + H2O 98 г 136 г
Відповідь: маса утвореної солі 13,6 г. |
Обчислення масової (об’ємної) частки виходу продукту реакції за відношенням до теоретичного.
Що треба знати та вміти:
1. Що означають поняття практичний і теоретичний вихід продукту
реакції?
2. Формули для обчислення масової (об’ємної) частки виходу продукту
реакції:
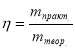 ∙100% , або
∙100% , або 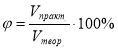
де ![]() - відповідно масова і об’ємна частки виходу продукту реакції;
- відповідно масова і об’ємна частки виходу продукту реакції;
![]() - маса і об’єм продукту реакції одержані практично;
- маса і об’єм продукту реакції одержані практично;
![]() - маса і об’єм продукту реакції розраховані за хімічним
- маса і об’єм продукту реакції розраховані за хімічним
рівнянням.
3. Розв’язувати задачі на розрахунок за хімічним рівнянням.
4. Складати рівняння хімічних реакцій.
5. Виконувати математичні дії, розв’язувати пропорції.
Приклад завдання. Обчислити масову частку виходу продукту реакції, якщо з 47,6 г амоніаку було одержано 172,9 г амоній сульфату.
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записати рівняння реакції і врівняти його.Обчислити молярні маси заданих речовин.
4.Розрахувати масу продукту реакції за рівнянням реакції (теоретичну).
5.Записуємо формулу для обчислення масової частки продукту реакції, підставляємо значення і робимо обчислення.
6.Записуємо відповідь.
|
Дано: m(NH3)=47,6 г m((NH4)2S04)=172,9 г
η - ?
2NH3 + H2SO4 = (NH4)2SO4 М(NH3)=17г/моль; М((NH4)2SO4)=130г/моль
47,6 г х 2NH3 + H2SO4 = (NH4)2SO4 34 г 130г
Відповідь: масова частка виходу амоній сульфату 95%. |
Приклад завдання. Водень об’ємом 8 л (н. у.) змішали з хлором. Утворився гідроген хлорид об’ємом 12 л. Яка об’ємна частка виходу продукту реакції за відношенням до теоретичного?
|
Порядок виконання |
Розв’язання |
|
1.Аналіз задачі та скорочений запис її умови.
2.Записати рівняння реакції і врівняти його.
3.Обчислити теоретичний вихід продукту реакції.
4.Обчислюємо обє’ємну частку виходу продукту реакції.
5.Записуємо відповідь.
|
Дано:
V(HCl)=12 л
φ -?
H2 + Cl2 = 2HCl
Оскільки всі речовини пребувають в газоподібному стані можна використати закон об’ємних відношень газів:
8 л х H2 + Cl2 = 2HCl 1л 2л
Відповідь: об’ємна частка виходу продукту реакції становить 75%. |
ВИСНОВКИ
Алгоритмічні приписи можна використовувати на різних етапах
навчання, як на уроках, так і в позаурочний час. Кожному учневі
рекомендується завести дидактичну папку, де містяться алгоритмічні
приписи.
Спостереження засвідчують, що учні з високим рівнем навчальних досягнень використовують алгоритмічні приписи при розв’язуванні лише декількох розрахункових задач, надалі потреби у приписах немає. Учні з достатнім і середнім рівнями навчальних досягнень звертаються до алгоритмічних приписів частіше, а учні з початковим рівнем постійно працюють з ними – не лише під час виконання тренувальних вправ, а й написання самостійних і контрольних робіт. Такий підхід до використання алгоритмічних приписів у навчанні учнів з початковим рівнем навчальних досягнень дає позитивні результати: створюється ситуація успіху, з’являється впевненість у власних силах і бажання вчитися. Тож застосування алгоритмічних приписів має позитивні аспекти щодо організації пізнавальної діяльності учнів з початковим рівнем навчальних досягнень
ВИКОРИСТАНА ЛІТЕРАТУРА
1. Програма для загальноосвітніх навчальних закладів. Хімія. 7 – 11 кл. К.:
Перун, 2005. – 31с.
2. Програми для профільного навчання учнів загальноосвітніх навчальних
закладів. Хімія. 10 -12 кл. Тернопіль: Мандрівець, 2010. – 248 с.
3. Буринська Н.М. Хімія: Методи розв’язування задач. – К.: «Либідь»,
1996. – 80 с.
4. Ольга Березан. Збірник задач з хімії. – Тернопіль: «Підручники та
посібники», 2007. – 320 с.
- Хомченко Г.П. збірник задач з хімії для вступників до вищих
навчальних закладів/ Г.П.Хомченко, І.Г.Хомченко; Пер. З рос. – К.:
Арій, 2008. – 320 с.
- Кукса С.П. 600 задач з хімії. – Тернопіль: Мандрівець, 1998.- 144 с.
- Цитович И.К.,Протасов П.Н. Методика решения расчетных задач по химии. – М.: «Просвещение», 1983. – 127 с.
- Савчин М.М. Збірник задач та вправ з неорганічної хімії. – Львів: ВНТЛ, 1998. – 160 с.
ЗМІСТ
Передмова...........................................................................................................3
Обчислення відносної молекулярної маси речовини……………………….4
Обчислення відношення мас елементів у складній речовині………………4
Обчислення маси елемента за відомою масою речовини…………………...5
Обчислення масової частки елемента у складній речовині за її
формулою………………………………………………………………………6
Виведення найпростіших формул речовин за масовими частками
елементів……………………………………………………………………….7
Виведення формули хімічної сполуки за масовими частками
елементів та відносною густиною……………………………………………8
Обчислення молекулярної формули речовини за відносною
густиною і масою (об’ємом) продуктів її згоряння…………………………9
Обчислення відносної густини газів………………………………………. 10
Обчислення кількості структурних частинок (молекул, атомів,
йонів) за кількістю речовини…………………………………………………11
Обчислення, пов’язані з використанням поняття “молярна маса»…………13
Обчислення, пов’язані з використанням поняття “молярний об’єм газу”…14
Обчислення, пов’язані з використанням закону об’ємних відношень
газів…………………………………………………………………………….15
Складання формул бінарних сполук за валентністю хімічних
елементів………………………………………………………………………16
Врівнювання рівнянь хімічних реакцій шляхом математичного
підбору коефіцієнтів………………………………………………………….18
Складання рівнянь окисно-відновних реакцій……………………………...19
Розв’язування розрахункових задач на обчислення за хімічними
рівняннями…………………………………………………………………….20
Обчислення масової частки і маси речовини в розчині…………………….24
Обчислення маси або об’єму продукту реакції за відомою
масою або об’ємом вихідної речовини, що містить домішки……………..27
Обчислення за рівняннями хімічних реакцій, якщо один із
реагентів взято у надлишку………………………………………………….29
Обчислення масової (об’ємної) частки виходу продукту реакції
за відношенням до теоретичного……………………………………………30
Висновки………………………………………………………………………32
Використана література………………………………………………………34
1

про публікацію авторської розробки
Додати розробку

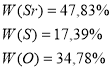
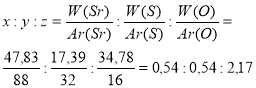
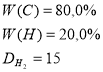

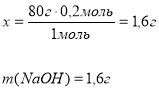
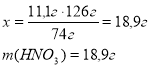
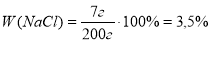
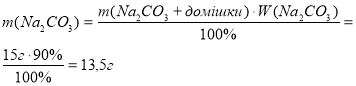
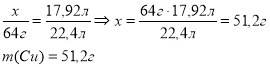
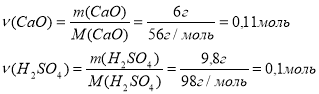
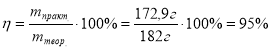
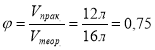 , або 75%
, або 75%