Тема: Електричний струм в розчинах і розплавах електролітів. Кількість речовини, що виділяється під час електролізу. Лабораторна робота №9. Дослідження явища електролізу.
Урок № 33-34
|
Класс |
9А |
9Б |
|
Дата |
13.01.13 |
14.01.13 |
Тема: Електричний струм в розчинах і розплавах електролітів. Кількість речовини, що виділяється під час електролізу. Лабораторна робота №9. Дослідження явища електролізу.
Мета: вивчити закони Фарадея, з’ясувати умови провідності електролітів, дослідити явище електролізу.
Задачі: роз’яснити учням фізичну природу електропровідності рідких провідників, навчити учнів застосовувати закони електролізу Фарадея під час розв’язання задач. Ознайомити з технічним застосуванням електролізу.
Розвивати уміння застосовувати вивчений матеріал при розв’язанні задач та у повсякденному житті.
Виховувати старанність, самостійність та відповідальність при виконанні завдань, поставлених вчителем.
Тип уроку: урок вивчення нового матеріалу
Демонстрації:
- фрагмент відеофільму явище електролізу;
- фрагмент відеофільму “Електроліз та його промислове застосування”.
Хід уроку
- Організаційно - психологічний етап.
Метод «Барон Мюнхгаузен». Вчитель пропонує явно неправдиві твердження із теми «Електричний струм», які спростовуються на уроці
1. Провідники не проводять електричний струм.
2. Електричний струм-це хаотичний рух заряджених частинок.
3. Діелектрики-це речовини, які проводять електричний струм.
4. Опір провідника залежить від сили струму та напруги.
5. Сила струму на ділянці електричного коло прямо пропорційна опору провідника та обернено пропорційна напрузі на цій ділянці.
6. При паралельному з’єднанні провідників сила струму незмінна.
- Етап підготовки до активного свідомого сприйняття матеріалу (постановка мети, мотивація, актуалізація опорних знань, вмінь).
Метод «Знаю – хочу довідатися – учуся». Учитель повідомляє учням тему для вивчення. Діти об'єднуються в пари і протягом 4–5 хвилин обговорюють один із одним усе, що їм відомо з теми. У цей час педагог креслить на дошці таблицю.
|
Що ми знаємо |
Що хочемо довідатися |
Що ми довідалися (вивчили) |
|
|
|
|
Вчитель надає слово кожній парі і з їхніх слів заповнює першу графу таблиці. При цьому він може редагувати інформацію. У тих випадках, коли учні не впевнені у своїх знаннях, записується інформація до другої графи.
Викладач пропонує школярам разом шукати відповіді на питання в другій графі.
- Виклад нового матеріалу
Рідини, як і тверді тіла, можуть бути діелектриками, провідниками і напівпровідниками. Діелектриком є також дистильована вода.
Фронтальний експеримент
Складемо коло за схемою (рис.1.)
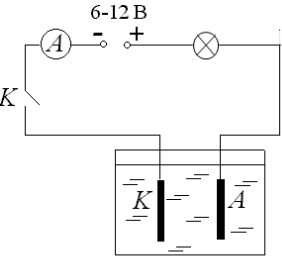
Рис.1.
Розглянемо три випадки:
- В склянку наллємо дистильовану воду і опустимо два електроди – струму в колі немає (лампа не світиться). Дистильована вода – діелектрик.
- В склянці насиплемо кухонну сіль (NaCl) – струму в колі немає (лампа не світиться). Кухонна сіль – діелектрик.
- В склянку наллємо дистильовану воду і розчинемо в ній кухонну сіл (розчин солі) – замкнувши ключем коло, лампа починає світитись.
Питання: Чому сіль і дистильована вода окремо не проводить струм а якщо їх змішати струм в колі є?
Пояснення досліду.
До провідників належать розплави і розчини електролітів: кислот, лугів і солей. Рідкими напівпровідниками є розплавлений селен, розплави сульфідів та ін.
Під час розчинення електролітів під впливом електричного поля полярних молекул води відбувається розпад молекул електролітів на іони. Цей процес називають електролітичною дисоціацією, в результаті якої нейтральні молекули розпадаються на позитивні та негативні іони. В електроліті з'являються вільні носії зарядів і він починає проводити струм. Оскільки заряд у водних розчинах чи розплавах електролітів переноситься іонами, то таку провідність називають іонною. За іонної провідності проходження струму пов'язано із перенесенням речовини. На електродах відбувається виділення речовин, які входять до складу електроліту. На аноді негативно заряджені частинки віддають свої зайві електрони (окиснювальна реакція), а на катоді позитивні іони отримують електрони (реакція відновлення). Процес виділення на електроді речовини, пов'язаний із окиснювально-відновлювальними реакціями, називають електролізом. У розчині може відбуватися процес об’єднання іонів у нейтральні молекули, такий процес називається рекомбінацією.
Розглянемо явище електролізу на прикладі мідного купоросу (складемо коло за схемою рис.1). В результаті електролітичної дисоціації CuSO4 = Cu2+ + SO42-. Позитивно заряджені іони міді під дією електричного струму будуть переміщуватися до катода, де отримають електрони і виділяться на ньому у вигляді нейтральних атомів міді (рис. 2.). Негативно заряджені іони під дією електричного поля перемістяться до анода, де віддадуть вільні електрони і також виділяться на ньому.
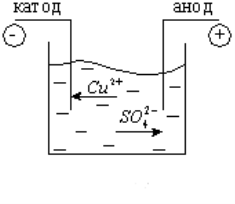
Рис.2.
Нехай за час t через електроліт буде перенесено заряд. Кількість іонів, які досягли електрода, дорівнюватиме:
![]() , (1)
, (1)
де q0 = Ze - заряд іона; Z - валентність іона; e - елементарний заряд.
Кількість іонів N дорівнює кількості атомів речовини, що виділиться на електроді, а маса виділеної речовини
![]() , (2)
, (2)
де m0 - маса одного атома, μ - молярна маса речовини.
Для кожного хімічного елемента можна у виразі (2) виділити сталу величину k, яку називають електрохімічним еквівалентом речовини:
![]() , (3)
, (3)
У СІ електрохімічний еквівалент вимірюють у кілограмах на кулон: [k] = кг/Кл.
Виходячи з цього можна записати, що m = kq = kIΔt (4)
Маса речовини, яка виділяється на катоді за час Δt, пропорційна силі струму і часу. Це твердження, встановлене експериментально Фарадеєм (1831 р.), має назву першого закону Фарадея для електролізу.
Електрохімічний еквівалент речовини визначено для всіх хімічних елементів. Він є табличною величиною, але його не важко розрахувати:, де ![]() – хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
– хімічний еквівалент речовини. Добуток числа Авогадро на заряд електрона називають сталою Фарадея:
F = NAe = 6,02·1023 1/моль ×1,6·10-19 Кл = 96500 Кл/моль.
Стала Фарадея дорівнює заряду, під час перенесення якого одновалентними іонами через розчин або розплав електроліту виділяється 1 моль речовини.
З цих міркувань вираз (4) набуде вигляду: ![]() (5)
(5)
Формула (5) виражає другий закон Фарадея для електролізу: електрохімічні еквіваленти різних речовин прямо пропорційні їх хімічним еквівалентам. Якщо у вираз (4) підставити співвідношення (3), то отримаємо об'єднаний закон Фарадея для електролізу:
![]()
Явище електролізу має широке застосування в електрометалургії (добування чистих металів); у гальваностегії (нанесення металевих покриттів для запобігання корозії металів); у гальванопластиці (виготовлення копій з матриць) тощо. Будову хімічних джерел струму (гальванічних елементів та акумуляторів) також засновано на процесах взаємодії металів з електролітами.
Фрагмент відеофільму “Електроліз та його промислове застосування”.
4. Первинне закріплення вивченого.
4.1 Питання для закріплення матеріалу
1. Які речовини належать до електролітів?
2. Що таке електролітична дисоціація?
3. Що називають електричним струмом у рідинах?
4. Чим зумовлено електропровідність електролітів?
5. Чому під час проходження струму через розчин електроліту відбувається перенесення речовини, а під час проходження по металевому провіднику не відбувається?
6. Що називають електролізом?
7. Що називають електрохімічним еквівалентом речовини? Який його фізичний зміст?
8. Наведіть приклади застосування електролізу.
4.2 Виконання лабораторної роботи №9. Дослідження явища електролізу.
5. Підсумок уроку.
Учні разом заповнюють третю колонку таблиці «Що ми довідалися (вивчили)» із вчителем фізики, а також дають відповіді на запитання із вчителем хімії:
- Я дізнався (дізналася) про багато нового.
- Мені це стане в пригоді в житті.
- На уроці було про що подумати.
- На всі запитання, що виникли на уроці, я одержав (-ла) відповіді.
6. Етап інформування учнів про домашнє завдання та інструктаж про його виконання.
Опрацювати відповідний параграф у підручнику.
Запитання після параграфу – усно.
Творче завдання.
Скласти задачу до даної теми та розв'язати її.
Опорні записи до конспекту учня
|
Електроліт — це розчин або розплав, що проводить електричний струм. УВАГА! Причиною дисоціації є не електричне поле, а дія розчинника або нагрівника. |
|
|
|
Електроліз — це процес виділення на електродах речовин внаслідок відновлювально-окислювальних реакцій, що відбуваються на електродах. Рекомбінація – процес об’єднання іонів у нейтральні молекули. |
|
m — маса речовими. μ — молярна маса NA — стала Авогадро, N — кількість іонів, Z — валентність e — заряд електрона, I—сила струму, F — стала Фарадея. |
Закон електролізу
m = k·I·t
F = NAe |
|
Застосування електролізу:
|
|


про публікацію авторської розробки
Додати розробку