Урок 16 Агрегатні стани речовини. Фізичні властивості тіл у різних агрегатних станах. Кристалічні та аморфні тіла.
8клас
Урок 16
Агрегатні стани речовини.
Фізичні властивості тіл у різних агрегатних станах.
Кристалічні та аморфні тіла.
Мета уроку:
навчальна:
- сформувати уявлення про агрегатні стани речовини й пояснити фізичні властивості речовин у різних агрегатних станах на основі положень молекулярно-кінетичної теорії;
- порівняти фізичні властивості тіл у різних агрегатних станах;
- познайомити учнів з кристалічними та аморфними тіла і наноматеріалами;
- застосування кристалів та аморфних тіл.
розвивальна:
- сформувати уявлення про фізичну картину світу;
- розвивати логічне мислення, навчити самостійно робити висновки, розвинути інтерес до вивчення фізики;
виховна:
- навчити знаходити прекрасне у природі, виховувати бережливе до неї ставлення;
- виховувати почуття взаєморозуміння та взаємодопомоги в процесі спільної діяльності;
- викликати цікавість до вивчення предмету.
Тип уроку: вивчення нового матеріалу
Обладнання: підручник, навчальна презентація, комп’ютер, два шприца,
металевий циліндр, склянка з водою, вода в колбі, лід, пальник,
скляна пластина для конденсації пари, кристали кам’яної солі,
пластилін, кусочок смоли, зразок каучуку, цукор рафінад,
маркери, ватман, таблиці.
Завдання уроку:
- визначити, від яких чинників залежать властивості речовин на прикладі води;
- експериментально підтвердити, що речовина може перебувати у 3-х агрегатних станах.
«Фізика – це наука розуміти природу»
/Е. Роджерс/.
Хід уроку
1. Організаційний момент.
Привітання, перевірка відсутніх.
2. Актуалізація опорних знань учнів
1. З чого складається будь-яка речовина?
2. Дати означення молекули.
3. Пояснити різницю між простими і складними речовинами.
4. Які явища свідчать про те що молекули рухаються?
5. Як залежить рух молекул від температури?
6. Як молекули взаємодіють між собою?
3.Мотивація навчальної діяльності.
Також з курсу природознавства ви знаєте, що практично будь-яка речовина може перебувати в різних агрегатних станах.
Давайте їх назвемо:
- Газоподібний;
- Рідкий;
- Твердий.
Сьогодні на уроці ми доповнимо та узагальнимо ваші знання про фізичні властивості тіл у різних агрегатних стана, навчимося розрізняти кристалічні та аморфні тіла.
- Назвіть відому вам речовину, яка може перебувати у трьох агрегатних станах? (Водяна пара, вода та лід)
Водяна пара, вода та лід – це три агрегатні стани тієї самої речовини, утвореної однаковими молекулами – молекулами води.
- Проблемне питання: «чому ж фізичні властивості речовин, які утворені однаковими молекулами, але перебувають у різних агрегатних станах, відрізняються одна від одної?»
Імовірно, причина такої відмінності полягає в тому, що молекули по-різному рухаються та взаємодіють.
- Які ж властивості мають речовини в різних агрегатних станах?
- Як при цьому рухаються та взаємодіють молекули?
Ми пригадали, що гази, рідини і тверді тіла відрізняються між собою.
Візьмемо два твердих тіла: алмаз і графіт. Як відомо з хімії – це алотропні видозміни Карбону.
- Чому алмаз у склорізі ріже скло, а графіт лише ковзає по склу? (вчитель демонструє дію склоріза і простого олівця з графітовим осердям).
- Чи можете ви дати відповідь на це запитання зараз?
Отже виявити відмінності внутрішньої будови твердих тіл та їх властивостей, а також практичну значущість теми і є метою нашого уроку.
4. Вивчення нового матеріалу
Як відомо, фізика – це наука про природу. Ми – частинка цієї природи, і чим краще ми будемо розуміти фізичні явища, тим краще будемо розуміти природу, тим раціональніше будемо використовувати її ресурси.
Практично будь-яка речовина залежно від фізичних умов може перебувати у трьох агрегатних станах: газоподібному, рідкому та твердому.
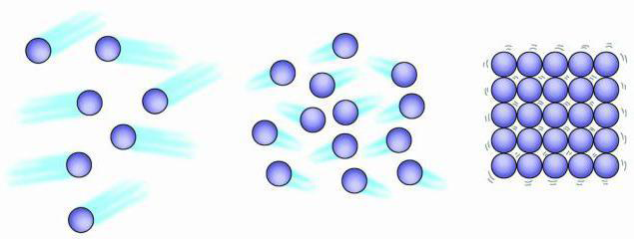
Мал. Моделі агрегатних станів речовини: газоподібний стан, рідкий та твердий
Молекули тієї самої речовини у твердому, рідкому та газоподібному станах ті самі, вони нічим не відрізняються одна від одної.
Той або інший стан речовини визначається розташуванням, характером руху та взаємодії молекул.
У газах при атмосферному тиску відстань між молекулами набагато більша від розмірів самих молекул, тому вони слабо притягуються одна до одної, і якщо газу не перешкоджають стінки посудини, його молекули розлітаються.
Речовини у газоподібному стані не мають власної форми та об'єму. Вони набувають форми та об'єму посудини в якій знаходяться.
У рідинах і твердих тілах молекули розміщені ближче одна до одної, взаємодія між ними значна. Тому молекули в рідинах і особливо в твердих тілах не можуть далеко віддалитися одна від одної.
Рідини не мають власної форми, а набувають форму посудини в якій знаходяться, проте мають власний об'єм.
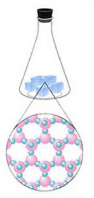
Тверді тіла мають власну форму і власний об’єм.

Звідси випливає, що тіло в однакових умовах у різних агрегатних станах має різну внутрішню енергію.
Кожен з агрегатних станів визначається розташуванням, характером руху та взаємодією мікрочастинок речовини
Фізичні властивості твердих тіл.
Пружність
Тверді тіла мають певні властивості, які притаманні кожному з них в тій чи іншій мірі. Тверді тіла намагаються зберегти форму і об’єм .
Спостереження показують, що тверді тіла сильно відрізняються своїми властивостями. Так, наприклад, якщо гумку стиснути, вона відновлює свою форму. Цю властивість називають пружністю.
Пружність – властивість тіла відновлювати свою форму після дії на нього сили.
Пластичність.
Віск і пластилін тверді тіла, але їх форму змінити легко. Вони є пластичними.
Пластичними називають тверді тіла, які не відновлюють свою форму після дії на них сили.
Крихкість.
Скло легко руйнується при дії на нього певної сили. Воно крихке, на відміну від міцних тіл, що не руйнуються при дії сили.
Крихкими називають тіла, що руйнуються при дії на них сили.
Фізичні властивості рідин
Рідини зберігають свій об’єм, але легко змінюють форму. Наприклад, рідина, перелита з мензурки в циліндр, має той же об’єм, але іншу форму.
Рідини текучі.
Унаслідок текучості рідина під дією земного тяжіння приймає форму посудини, в якій перебуває. Верхній шар рідини утворює горизонтальну поверхню.
Фізичні властивості газів.
Якщо помістити газ в закриту посудину, він займе весь її об’єм. Гази легко змінюють форму і об’єм, тому заповнюють усю посудину, незалежно від її об’єму і форми. Вони легко стискаються.
- Чому ж так відрізняються властивості речовини в різних станах? Адже і газ і рідина і тверде тіло складаються з одних і тих самих молекул!
(Відмінності обумовлені характером розташування, руху та взаємодії молекул)
Тверді тіла ділять на дві групи: кристалічні й аморфні.
У кристалічних тіл частинки кристалів розміщені у вузлах кристалічної решітки у строгому порядку, який називають дальнім. Весь кристал можна отримати шляхом багаторазового повторення того самого структурного елемента, який називають елементарною коміркою. Строгий порядок у розміщенні частинок кристала зумовлює його правильну геометричну форму та блиск.
Кристалічні тіла поділяють на монокристали, які можуть мати великі розміри і правильні геометричні форми (придивись до кубиків кухонної солі); і полікристали, які утворюються з великих спаяних агрегатів із дрібних монокристалів, що мають хаотичну орієнтацію (видно на зламі мідного чи алюмінієвого дроту або чавунної сковороди).
Монокристал - один суцільний кристал.



Полікристал - сукупність хаотично розміщених монокристалів, що зрослись.



Аморфні тіла кристалічної решітки не мають. Строгого порядку у розміщенні частинок немає. Відстані між частинками менші, ніж у рідині, але більші, ніж у кристалів.



До аморфних тіл належать бурштин, скло, смола, плавлений цукор, плавлений кварц та ін. До аморфних тіл відносять і полімери (деревина, природний та синтетичний каучук, поліетилен, пластики), молекули яких мають вигляд довгих ланцюгів, що містять сотні тисяч атомів.



Аморфні тверді тіла (наприклад, скло) своєю структурою нагадують тверду рідину. Але з часом скло «пливе», може кристалізуватися.
Нагріваючи речовину можна перевести з твердого стану в рідкий чи газоподібний. І навпаки, охолоджуючи речовину її можна перевести з газоподібного в рідкий і твердий стани.
Кожна кристалічна речовина плавиться за певної температури. На відміну від кристалічних тіл, аморфні речовини не мають певної температури плавлення - вони переходять у рідкий стан, поступово розм’якшуючись.
Наллємо воду у форму для льоду і поставимо у морозильну камеру холодильника. Через деякий час вода перетвориться на лід. Дістанемо утворені шматочки льоду і нагріємо їх. Лід досить швидко перетвориться на рідину. Продовжимо нагрівання. Через деякий час вода починає кипіти та перетворюватись на водяну пару, її легко виявити, потримавши холодний металевий, скляний чи порцеляновий предмет над отвором посудини. Від зіткнення з його холодною поверхнею водяна пара охолоджується і знову перетворюється на рідину. Отже, ми спостерігали за зміною агрегатних станів води.


Подібні зміни відбуваються з водою і в природі. Тому у природі вода трапляється у всіх агрегатних станах. Зокрема, у хмарах у вигляді пари, у річках і озерах улітку у вигляді рідини, взимку у вигляді рідини та льоду. Навіть у повітрі, яким ми дихаємо, є водяна пара. Пригадай, як холодної пори вікна «пітніють» (вкриваються крапельками води).
Діти, вода – це унікальна речовина. Тільки її можна спостерігати відразу в трьох агрегатних станах. Всі тіла при нагріванні розширюються, при охолодженні стискаються. Всі крім води. Вода має дивовижні властивості, які відрізняються від властивостей інших рідин. Під час нагрівання від 00 C до + 40C вода не розширюється, а стискається. При + 40C вода має найбільшу густину 1000 кг/м3 . Завдяки цьому взимку «важка» вода опускається на дно річок і озер. Ось чому водойма рідко промерзають узимку до дна і риби та інші живі організми річок можуть жити під шаром льоду.
При замерзанні вода розширюється. Тому не можна залишати на морозі скляні посудини з водою, бо при замерзанні вода розширюється і скляний посуд може тріснути. Дивні властивості води до кінця не з’ясовані, але головна причина відома: будова молекул води.
А чи знаєте ви, що організм людини на 65 % складається з води (75% у немовля, 60% у дорослої людини). Втрата організмом людини більш ніж 10 % води може призвести до смерті, якщо вчасно не втрутитися. Без води взагалі не можливе життя на землі. Тому ми повинні бережливо ставитися до неї, економно використовувати , не засмічувати річки та озера.
Існує ще один агрегатний стан речовини - плазма - частково або повністю йонізований газ, тобто газ, який складається з величезної кількості заряджених частинок (йонів і електронів) та нейтральних атомів і молекул. Плазма - найпоширеніший стан речовини у Всесвіті.

2. Наноматеріали.
У 1931 році німецькі фізики Макс Кнолл і Ернст Pyска створили електронний мікроскоп, який уперше дозволив досліджувати об’єкти дуже малих розмірів. Цей рік вважається початком розвитку нанотехнологій —
науки, в якій вивчаються закономірності фізичних і хімічних систем протяжністю порядку декількох нанометрів або часток нанометра.
Наноматеріали — матеріали, створені з використанням наночасток та/або за допомогою нанотехнологій, що мають певні унікальні властивості, зумовлені присутністю цих частинок у матеріалі. До наноматеріалів відносять об'єкти, один з характерних розмірів яких лежить в інтервалі від 1 до 100 нм.
В нанокристалічних матеріалах істотно змінюються механічні властивості. За певних умов ці матеріали можуть бути надтвердими або надпластичниими. Наприклад, в кристалічного нікелю при переході до нанорозмірів міцність і твердість зростають у декілька разів; додавання алюмінію, структура якого має нанорозміри, в ракетне паливо значно змінює його швидкість згорання.
 Мал. Найлегший матеріал.
Мал. Найлегший матеріал.
Досягти такого ефекту вченим вдалося завдяки видаленню всієї вологи, яка перебувала у вуглецевому ланцюгу нанотрубок, причому структуру самих нанотрубок зберегти вдалося повністю.
Використання наноматеріалів дозволяє значно підвищити ефективність існуючих технологій. Сонячні елементи, при виготовленні яких використовують металеві наноантени, можуть поглинати до 80% енергії сонячного світла, тоді як існуючі сонячні батареї можуть використовувати тільки 20% енергії. В сучасних акумуляторах замість вуглецю використовують іони літію. Це дозволило значно збільшити їхню ємність та розширити діапазон використання. Використання наноматеріалів при виготовленні ліків дозволяє зменшити розмір таблеток та підвищити вміст лікувальної речовини у крові. Наночастинки також широко застосовують у харчовій промисловості та при виготовленні фарб.
Але, з іншого боку, висока біологічна активність наночастинок може бути небезпечною для здоров’я людини. Багато наночастинок мають високу проникаючу здатність і легко проникають у клітини. Ефекти, пов’язані з попаданням наночастинок у мозок, печінку та інші життєво важливі органи, можуть бути небезпечними для здоров’я та життя живих організмів.
5. Застосування та закріплення вивченого матеріалу.
Бесіда за питаннями
1. Які три агрегатні стани ми сьогодні з вами вивчили?
2. Як пояснити існування речовини в різних агрегатних станах на основі положень молекулярно-кінетичної теорії?
2. Чому рідини важко стиснути?
3. Чи є відмінність між молекулами води, пари і льоду?
4. Чи змінюється під час охолодження шматка заліза його об’єм, маса, щільність упакування атомів, а також середня швидкість руху молекул?
5. Чи можна вважати, що об’єм газу в посудині дорівнює сумі об’ємів його частинок?
6. У якому сані перебуває речовина в надрах зір?
7. У чому подібність і у чому відмінність кристалічних і аморфних тіл?
8. Як рухаються і взаємодіють атоми газу?
9. Чому сніг на морозі рипить під ногами?
10. Чи можна стверджувати, що ртуть – завжди рідина, а кисень – завжди газ?
11. У якому агрегатному стані може перебувати речовина, якщо вона займає весь наданий їй об’єм?
12.У якому агрегатному стані (газоподібному, рідкому чи твердому) вода утворює туман?
6. Підсумок уроку
• Речовина може перебувати в різних агрегатних станах: твердому, рідкому, газовому.
• Агрегатний стан речовини пояснюється внутрішньою будовою, розміщенням, рухом і взаємодією її мікрочастинок.
• Фізичні властивості твердих тіл, рідин і газів пояснюються їх внутрішньою будовою.
7. Домашнє завдання.
1. Опрацювати § 10
2. Вправа 10 (1,3)


про публікацію авторської розробки
Додати розробку
