Урок № 26 «STEM- проект. Лабораторна робота. Практичне застосування електролізу в домашніх умовах . Цинкування.»
Розробка проектувальної діяльності вчителя та учнів на рівні теми: «Електричні явища. Електричний струм.» , на рівні уроку № 26 «STEM- проект. Лабораторна робота. Практичне застосування електролізу в домашніх умовах . Цинкування.»
Тема: «STEM- проект. Лабораторна робота. Практичне застосування електролізу в домашніх умовах . Цинкування.»
Мета:
- Освітня. Сформувати знання про електричний струм в розчинах та розплавах електролітів; виявити основні особливості процесу електролізу; ознайомити з законом електролізу (І законом Фарадея), застосуванням електролізу , експериментальним шляхом перевірити доцільність практичного застосування електролізу в домашніх умовах.
- Розвиваюча. Розвивати вміння спостерігати, аналізувати фізичні, хімічні та біологічні явища, робити висновки.
- Виховна. Формувати вміння критично, але об'єктивно оцінювати предмети, явища; вміння працювати в колективі.
Тип уроку. Інтегрований STEM- проект з елементами лабораторних досліджень .
Прилади та матеріали для роботи з учнями:
- Комп’ютерна презентація до уроку, камера , фотоапарат;
- набір для проведення лабораторного дослідження з цинкування в домашніх умовах: паяльна кислота, тубус від батарейки, затискачі, пінцет, 2 гайки , знежирювач, з’єднувальні дроти, джерело струму, серветка, електронні ваги, підставка, електролітична ванна з дистильованою водою, щіпка цукру та солі, лампа розжарювання, гальванометр;
- Захисний одяг – халати , рукавички, окуляру , маски;
- Ватмани , кольорові олівці, маркери, калькулятори, робочі зошити;
- Флеш – анімація Дисоціація https://www.vascak.cz/data/android/physicsatschool/template.php?s=elkap_disociace&l=ua
Флеш – анімація Електроліз
https://www.vascak.cz/data/android/physicsatschool/template.php?f=elkap_rozkladne&l=ua
Флеш – анімація Свинцево – кислотний акумулятор https://www.vascak.cz/data/android/physicsatschool/template.php?f=elkap_akumulator&l=ua
Відео Електричний струм в електролітах. https://www.youtube.com/watch?v=jlRxieufAOo
З метою з’ясування умов , при яких відбувається електроліз проведено
слідуючі демонмтрації:
- Демонстрація. Дистильована вода - діелектрик (джерело струму, з’єднувальні провідники, гальванометр, ключ, електролітична ванна з дистильованою водою, електроди, лампа розжарювання).
- Демонстрація. Електричний струм у водному розчині кухонної солі (джерело струму, з’єднувальні провідники, електролітична ванна з дистильованою водою, щіпка кухонної солі, лампа розжарювання, гальванометр). 3.
- Демонстрація. Водний розчин цукру не проводить електричного струму (джерело струму, з’єднувальні провідники, електролітична ванна з дистильованою водою, щіпка цукру, лампа розжарювання, гальванометр).
План уроку:
1.Організаційний момент.
2.Актуалізація опорних знань.
3. Повторення вивчення матеріалу.
4. Проведення лабораторних досліджень.
5. Запитання на закріплення вивченого.
6. Домашнє завдання.
7. Для допитливих.
Хід уроку
- Організаційний момент.
Привітання, відмічання відсутніх .
Вчитель: « Доброго дня , учні. Сьогодні на уроці ми з вами будемо мати можливість експериментально перевірити виконання законів електролізу.»
- Актуалізація опорних знань.
Вчитель: « Давайте пригадаємо раніше вивчений матеріал і спробуєте дати відповіді на слідуючі запитання:
1. Що таке електричний струм? Які умови існування електричного струму?
2. Які дії спричиняє струм?
3. Які частинки є вільними носіями заряду в металах?
4. Чи переноситься речовина при проходженні струму через метали?
5. Як залежить опір металів від температури?
6. Як проявляється хімічна дія струму?
Чіткі обгрунтовані відповіді учнів.
3. Повторення вивчення матеріалу з теми : « Електролітична дисоціація.
Електроліз.»
Вчитель: « З попередніх уроків ви пам’ятаєте такі поняття:
Електроліти - це речовини, що мають йонну провідність. В твердому стані йони міцно зв’язані один з одним, оскільки мають протилежні електричні заряди, тому їхня рухливість ускладнена. У розплаві або розчині рухливість йонів збільшується. У розчині під впливом полярних молекул води речовина-електроліт розпадається на позитивно й негативно заряджені йони.
Розпад деяких речовин на йони під дією полярних молекул води називається електролітичною дисоціацією.
Якщо в розчині створити електричне поле, то позитивно заряджені йони рухатимуться до катода (негативно заряджений електрод), а негативно заряджені йони - до анода (позитивно заряджений електрод). Тому позитивно заряджені йони назвали катіонами, а негативно заряджені - аніонами.
Проходження електричного струму через електроліт характеризується тим, що відбувається перенесення хімічних складових електроліту й ті виділяються на електродах у вигляді твердого шару або в газоподібному стані.
Наприклад, якщо через водний розчин купрум хлориду протягом кількох хвилин пропускати струм, то поверхню катода вкриє тонкий шар міді, а біля анода виділиться газоподібний хлор. Наявність хлору можна визначити за характерним запахом або, якщо попередньо обгорнути анод кольоровою тканиною, - за її знебарвленням.
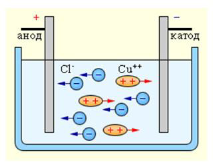 Електроліз - процес виділення речовини на електродах під час протікання електричного струму крізь розчин або розплав електролітів.
Електроліз - процес виділення речовини на електродах під час протікання електричного струму крізь розчин або розплав електролітів.
Струм в електролітах супроводжується перенесенням речовини.
Електричний струм у розчинах електролітів - це впорядкований рух йонів.
Опір електролітів з підвищенням їх температури зменшується.
Закони електролізу
У 1833-1834 pp. видатний англійський вчений Майкл Фарадей ( https://uk.wikipedia.org/wiki/Майкл_Фарадей  ) експериментально встановив кількісні співвідношення, що описують явище електролізу. Перший закон Фарадея для електролізу дає змогу обчислити масу речовини, яка виділяється на електроді.
) експериментально встановив кількісні співвідношення, що описують явище електролізу. Перший закон Фарадея для електролізу дає змогу обчислити масу речовини, яка виділяється на електроді.
І закон Фарадея.
Маса речовини, яка виділяється на катоді під час електролізу, прямо пропорційна електричному
заряду. Що проходить через електроліт, або добутку сили струму і часу проходження струму через електроліт.
m = kq= kIt
де m – маса речовини, виділеної на електроді;
k - коефіцієнт пропорційності, який називається електрохімічний еквівалент даної речовини.
q - заряд, що походить через електроліт.
I - сила струму в колі.
t - час проходження електричного струму через електроліт.
Електрохімічний еквівалент речовини дорівнює масі речовини, яка виділяється на електроді за 1с під час проходження через електроліт струму силою 1А.
ІІ закон Фарадея характеризує властивості електрохімічного еквіваленту.
Електрохімічний еквівалент речовини прямо пропорційний масі її молів і обернено пропорційний її валентності.


про публікацію авторської розробки
Додати розробку
