Урок. Алюміній. Місце у п.с, властивості та застосування.
Тема. Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію.
Мета: пояснити відмінність Алюмінію як хімічного елемента та алюмінію як простої речовини, вивчити фізичні властивості алюмінію, звернути увагу на його стійкість до корозії, формувати вміння працювати з опорними схемами, дати характеристику хімічним властивостям алюмінію.
Очікуваний результат:
Учень:
- розпізнає елемент та просту речовину,
- описує фізичні властивості алюмінію,
- називає продукти взаємодії,
- складає рівняння реакцій, що характеризують хімічні властивості алюмінію,
- аналізує властивості відповідно до будови атома алюмінію,
- обґрунтовує матеріал та робить висновки.
Тип уроку: урок вивчення нового матеріалу.
Форми проведення: робота з підручником, демонстрація зразків виробів з алюмінію, робота з схемами «Поширення алюмінію в природі» та «Хімічні властивості алюмінію», хімічний диктант.
Обладнання та реактиви: шматочки алюмінію, зразки виробів з алюмінію.
І. Організаційний момент.
ІІ. Аналіз залікової роботи.
ІІІ. Мотивація навчальної діяльності.
Вчитель. В переліку найважливіших металів є ще один метал – алюміній. Він широко використовується в транспортному машинобудуванні. Наприклад, для конструювання літаків, кораблів, автомобілів. У хімічній промисловості алюміній використовується в якості відновника. В будівельній промисловості – для виготовлення віконних рам і дверей, а в харчовій – для виготовлення пакувальних матеріалів. В побуті він використовується в якості матеріалу для виготовлення кухонного посуду та у вигляді фольги для зберігання харчових продуктів. Різноманітне застосування і широке використання алюмінію обумовлено цілим рядом його фізичних і хімічних властивостей, якими він вигідно відрізняється від інших металів. І на сьогоднішньому уроці ми обговоримо ці властивості, а також зупинимося на характеристиці Алюмінію як хімічного елемента. Цей метал вперше був одержаний німецьким хіміком Ф. Велером, а в 1856 році французький хімік Сен – Клер Девіль виділив його електрохімічним методом.
ІV. Вивчення нового матеріалу.
Вчитель. Почнемо із загальної характеристики Алюмінію за положенням у періодичній системі.
![]()
 порядковий номер
порядковий номер
13
![]()
![]() символ Al 26,982 атомна маса
символ Al 26,982 атомна маса
![]() назва елемента Алюміній
назва елемента Алюміній
![]() 3S23P1 електронна конфігурація
3S23P1 електронна конфігурація
![]() розподіл електронів 2/8/3
розподіл електронів 2/8/3
Завдання для учнів. Користуючись періодичною системою, охарактеризуйте Алюміній як хімічний елемент.
Вчитель. Хімічний елемент Алюміній утворює просту речовину – алюміній, яка має металічні властивості. (Демонстрація зразків виробів з алюмінію). Це сріблясто-білий метал з високою електропровідністю (поступається лише сріблу та міді) та теплопровідністю (теплопровідність його у 1,8 рази більша, ніж у міді, і в 9 раз більше, ніж у нержавіючої сталі). Він має невелику густину (2,7 г/см3), яка приблизно утричі менша, ніж у заліза, міді і цинку. І все ж це дуже міцний метал. Поряд з цим, легкоплавкий – 6600С. Три електрони з зовнішньої оболонки атома Алюмінію делокалізовані по кристалічній ґратці металічного алюмінію. Ця ґратка має гранецентровану кубічну структуру, подібно ґраткам олова та золота. Тому алюміній – один із кращих металів, що куються. Крім того, алюміній – найпоширеніший метал у природі.
Пригадаємо схему поширення металів у природі.
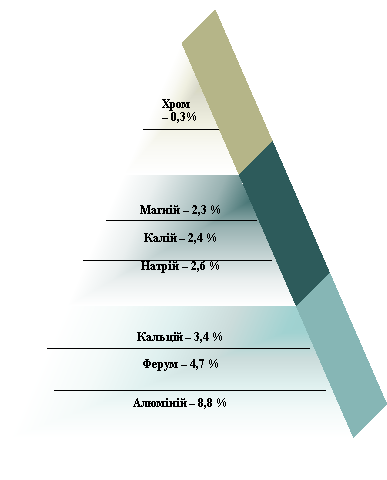
Вчитель. Хімічні властивості металічного алюмінію зумовлені такими характеристиками (Характеристику алюмінію учні можуть скласти самостійно за підручником):
- На зовнішньому енергетичному рівні – три електрони
- Ступінь окиснення: +3.
- У сполуках проявляє валентність – ІІІ.
- Є амфотерним металом – сполуки оксид і гідроксид мають амфотерні властивості.
- Взаємодіє з лугами 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
- Не піддається корозії за звичайних умов через утворення стійкої оксидної плівки.
- Проте, якщо оксидну плівку зняти, то алюміній досить хімічно активний метал.
Слід зазначити, що алюміній легко взаємодіє з галогенами, киснем і всіма неметалами при підвищеній температурі на початку реакції. Далі реакції протікають досить інтенсивно з виділенням великої кількості тепла. Алюміній сульфід може існувати тільки у твердому вигляді. Ще алюміній реагує із складними речовинами, добре розчиняється у розбавлених сульфатній і хлоридній кислотах, розведена нітратна кислота на холоді пасивує алюміній. Він легко забирає Оксиген та галогени від оксидів і солей інших металів.
Найбільш виражені властивості алюмінію показано у схемі:
+ 3O2 (киснем)
![]()
![]()
+ 3Cl2 (галогенами)
![]()
+ 3S (сіркою)
![]()
![]() Al + 3H2SO4 (кислотами)
Al + 3H2SO4 (кислотами)
![]()
+ 3CuSO4 (солями)
![]()
+ 2NaOH + 2H2O
![]()
Вчитель. Допишіть рівняння реакцій, що лежать в основі схеми.
У електрохімічному ряду напруг алюміній стоїть за найактивнішими металами. Але на поверхні алюмінію утворюється оксидна плівка, тому за звичайних умов на алюміній не діє ні кисень, ні вода. Якщо поверхню алюмінію протерти сіллю ртуті, то відбудеться реакція: 2Al + 3HgCl2 2AlCl3 + 3Hg
Виділена ртуть розчиняє алюміній – амальгама алюмінію. На амальгамованій поверхні оксидна плівка не тримається, тому алюміній реагує з водою за звичайних умов.
2Al + 6H2O 2Al(OH)3 + 3H2
V. Закріплення вивченого.
1. Хімічний диктант:
Алюміній розташований у … періоді, … групі, … підгрупі. Порядковий номер в алюмінію … . Це означає, що ядро містить 13 електронів, … протонів та … нейтронів. Алюміній у сполуках проявляє валентність … . На повітрі вироби з алюмінію не піддаються корозії, через утворення … . Алюміній пасивує … . Якщо поверхню алюмінію протерти сіллю, то … . При підвищеній температурі на початку реакції алюміній реагує з …, …, … .
2. Напишіть рівняння згаданих у хімічному диктанті реакцій.
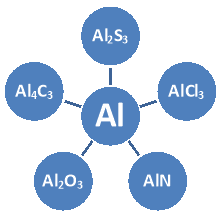
3. Здійсніть перетворення за схемою:
VІ. Рефлексія.
- Що вас сьогодні зацікавило на уроці?
- Чому, на вашу думку, алюміній реагує не з усіма кислотами?
- Що відмінне має хімічний елемент Алюміній від атома простої речовини алюмінію?
- Який вплив має навколишнього середовища на вироби з алюмінію?
VІІ. Домашнє завдання: відповідні параграф у підручнику та сторінка у друкованому робочому зошиті з хімії (автор М.М.Савчин), підготувати коротку інформацію про застосування алюмінію та його сполук.


про публікацію авторської розробки
Додати розробку
