Урок "Будова енергетичних рівнів атомів. Електронні та графічні електронні формули атомів s-, p-, d-елементів."
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЦЕНТРАЛЬНОУКРАЇНСЬКИЙ ДЕРЖАВНИЙ ПЕДАГОГІЧНИЙ УНІВЕРСИТЕТ
ІМЕНІ ВОЛОДИМИРА ВИННИЧЕНКА
природничо-географічний факультет
Кафедра біології та методики її викладання
«ЗАТВЕРДЖУЮ»
![]() Груповий методист
Груповий методист
![]() Вчитель біології
Вчитель біології
![]()
![]()
![]() « » 20 року
« » 20 року
КОНСПЕКТ УРОКУ
З біології в 11 класі
Навчально-виховний комплекс Знам’янська загальноосвітня школа
I-III ступенів №2-ліцей
студента-практиканта II курсу
природничо-географічного факультету
ЦДПУ імені Володимира Винниченка
спеціальності 014 Середня освіта (Біологія та здоров’я людини)
Коваленко Катерини Сергіївни
![]()
![]()
![]() Дата проведення уроку « » 20 року
Дата проведення уроку « » 20 року
![]()
![]() Оцінка вчителя
Оцінка вчителя
(підпис вчителя)
Тема: Будова енергетичних рівнів атомів. Електронні та графічні електронні формули атомів s-, p-, d-елементів.
Мета: освітня: навчити складати електронні формули, схемирозподілу електронів по квантових комірках для елементів I—III періодів; формувати вміння учнів визначати електронну будову атома за його положенням у періодичній системі; формувати уявлення учнів про єдину природу матеріального світу;
розвивальна: розвивати творчі здібності учнів, уважність;
виховна: сприяти розширенню політехнічного світогляду учнів, виховувати любов до предмету.
Тип уроку: комбінований; урок формування вмінь і навичок.
Підходи: діяльнісний, природоохоронний та здоров’язберігаючий.
Методи та прийоми: 1) інформаційно-рецептивний;
а) словесний (розповідь, пояснення, бесіда, опис, порівняння),
б) наочний (ілюстрація, демонстрація).
2)репродуктивний (конкретизація і закріплення уже набутих знань).
3) візуальний (запис ключових моментів в зошитах учнями класу).
4) релаксація.
Міжпредметні зв’язки: хімія, фізика.
Обладнання: мультимедійна дошка, презентація, конспект, підручники, зошити, зображення, періодична система хімічних елементів Д. І. Менделєєва, малюнки із зображенням s- , p-, i d-орбіталей.
Базові поняття: електрон, орбіталь, спін, енергетичний рівень, енергетичний підрівень, електронна оболонка.
Ключові компетентності:
- спілкування державною мовою;
- ініціативність і підприємливість (генерувати нові ідеї, ініціативи щодо проектної, винахідницької діяльності, ефективного використання природних ресурсів, уміння раціонально вести себе як споживач, залучати до діяльності, зокрема до природоохоронної чи наукової);
- основні компетентності у природничих науках і технологіях;
- екологічна грамотність і здорове життя;
- уміння вчитися впродовж життя.
Хід уроку:
І. Організація класу. Привітання і вступне слово до учасників уроку.
 ІІ. Актуалізація опорних знань.
ІІ. Актуалізація опорних знань.
Виконайте завдання за посиланням:
https://learningapps.org/display?v=pjk9j8dtc20
ІІІ. Мотивація навчальної діяльності учнів.
Вдома, готуючись до уроку та вивчаючи § 1, ви ознайомилися з розподілом електронів на енергетичних рівнях і підрівнях. Його відображають електронними та графічними електронними формулами. Сьогодні на уроці ми детально розберемо алгоритм написання електронних та графічних електронних формул. Тож запишіть тему сьогоднішнього уроку «Будова енергетичних рівнів атомів. Електронні та графічні електронні формули атомів s-, p-, d-елементів.»
IV. Вивчення нового матеріалу.
Вчитель: У 8 класі ви вже мали справу з електронними й графічними електронними формулами. Давайте пригадаємо та запишимо:
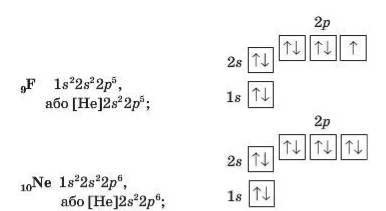
Електронна формула атома — це запис розподілу електронів в електронній оболонці атома, де коефіцієнтами позначають енергетичні рівні (1, 2, ... 7), символами — підрівні (s, p, d, f), верхніми індексами — кількість електронів на підрівнях. Наприклад, електронна формула атома Силіцію 14Si така: 1s22s22p63s23p2. (запис до зошита).
Графічні електронні формули доповнюють інформацію про будову електронної оболонки атома відомостями про кількість енергетичних комірок (кожну комірку позначають квадратиком) та заповнення їх електронами. Два спарені електрони однієї комірки позначають двома протилежно спрямованими стрілками ⇅, неспарений електрон — однією ↑. Протилежно спрямовані стрілочки вказують на те, що спарені електрони обертаються навколо своєї осі в протилежних напрямках.
Графічна електронна формула атома — відображення розподілу електронів за енергетичними комірками (запис до зошита).
Приклад графічної електронної формули наведено на малюнку 1.
Демонстрація 2,3 2. Форми електронних орбіталей (у тому числі 3D-проектування).
3. Моделі атомів s-, p-, d-елементів (у тому числі 3D-проектування).
(вчитель демонструє на слайді, учні замальовують до зошитів).
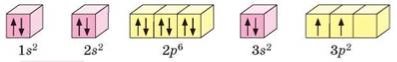
Мал. 1. Графічна електронна формула атома Силіцію
Що слід пам’ятати під час склдання електронних і графічних електронних формул.
- У межах одного рівня кількість підрівнів визначається кількістю наявних форм орбіталей.
- На першому енергетичному рівні перебувають електрони лише зі сферичною формою орбіталей, тобто s-електрони, вони утворюють s-підрівень. Отже, на першому енергетичному рівні існує один підрівень.
- На другому енергетичному рівні розміщені електрони зі сферичною та гантелеподібною формами орбіталей, тобто s- та p-електрони. Відповідно до цього другий рівень включає два підрівні — s-підрівень та р-підрівень. (Назви підрівнів повторюють назви орбіталей.)
- На третьому енергетичному рівні є три підрівні: s-, p-, d-. Тобто, з'являється d-підрівень. Його заповнення d-електронами відбувається в атомів хімічних елементів з протонними числами 21-30 (атоми хімічних елементів четвертого періоду).
- Четвертий підрівень називається — f-підрівнем і з'являється він на четвертому енергетичному рівні у хімічного елемента Церію (протонне число 58).
- Оскільки s-підрівень містить лише одну s-орбіталь, то на ньому можливе перебування не більше двох s-електронів. р-Підрівень містить три р-орбіталі, тому на ньому може перебувати максимально шість р-електронів. На d-підрівні налічується п'ять орбіталей, тож максимальне число d-електронів на ньому — десять. Щоб заповнити сім орбіталей f-підрівня, знадобиться чотирнадцять f-електронів.
Вчитель демонструє мал. 2, на якому наведено графічні зображення орбіталей перших чотирьох енергетичних рівнів.
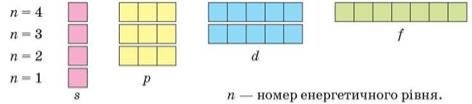
Мал. 2. Структура перших чотирьох енергетичних рівнів
Те, що на підрівні вдвічі більше електронів, ніж орбіталей, пояснюється існуванням спарених електронів.
Наявність неспарених електронів і вільних енергетичних комірок має значення для утворення хімічних зв'язків.
Узагальнену інформацію про максимальну кількість електронів та енергетичних комірок на підрівнях наведено в таблиці 1.
Таблиця 1
Максимальна кількість електронів та енергетичних комірок на підрівнях
|
Умовне позначення підрівнів |
s |
p |
d |
f |
|
Максимально можлива кількість електронів на підрівні |
2 |
6 |
10 |
14 |
|
Максимально можлива кількість енергетичних комірок |
1 |
3 |
5 |
7 |
(Вчитель пояснює матеріал з відповідними записами на дошці, учні записують і отримують опорний конспект.)
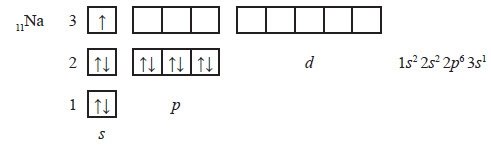
Вчитель: Припустимо, у вас є завдання: “Написати електронну і графічну електронну формулу для атома Na”.
Розглянемо покрокові етапи – як виконувати це завдання.
1. Визначаємо місце заданого елемента в періодичній системі хімічних елементів і деякі його характеристики (усно).
Na знаходиться в І групі (головні підгрупі – лужний метал), 3 періоді (малому).
Порядковий номер (атомне число), кількість електронів, протонів, протонне число – 11.
Нуклонне число – 23.
2. Визначаємо заряд ядра атома Na (усно)
Заряд ядра Na – +11 (обов’язково враховуємо “+”).
3. Визначаємо кількість енергетичних рівнів і кількість електронів на них (усно)
Na знаходиться
– в 3 періоді – отже, має 3 енергетичні рівні;
– в І групі – отже, на останньому рівні буде 1 електрон (1е-)
Електронна формула
1. Знаючи дещо про елемент, починаємо оформлювати дані в електронну формулу
Запис починаємо з того, що уже знаємо:
Na +11 ) ) )
Примітка!!!! Дужки – ))) – це кількість енергетичних рівнів, ми уже розібрались, що їх є 3, отже, ставимо три дужки.
2. Починаємо розписувати енергетичні рівні і підрівні. Щоб це робити правильно, потрібно дуже добре вивчити декілька простеньких правил.
- Завжди починаємо з 1 рівня.
- Усі рівні пишемо за порядком – 1,2,3. Упускати якийсь не можна.
- Номер рівня вказує на кількість підрівнів на ньому. Якщо рівень 1, то підрівень він має лише 1; якщо рівень №2, то підрівнів у нього теж 2.
1 рівень – лише s-підрівень;
2 рівень – s-підрівень і р-підрівень;
3 рівень – s-підрівень, р-підрівень і d-підрівень
4 рівень – s-підрівень, р-підрівень, d-підрівень і f-підрівень.
Підрівні мають строго визначену кількість електронів:
s-підрівень – 2е-
р-підрівень – 6е-
d-підрівень – 10е-
f-підрівень – 14е-
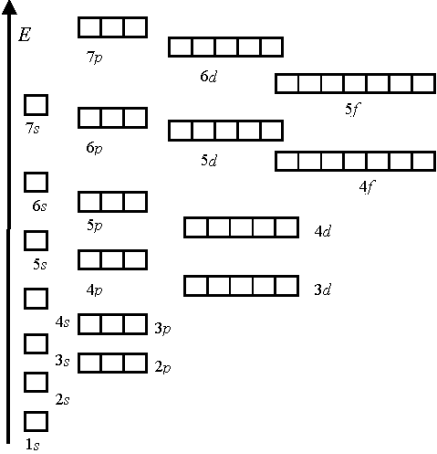
Увага! на 4 рівні після 4s-підрівня заповнюється 3d!! -підрівень, а не 4p. (Згідно з принципом Паулі)
Підрівні заповнюються електронами по порядку – s-підрівень, р-підрівень, d-підрівень і f-підрівень. Перш ніж перейти до заповнення р-підрівня, необхідно заповнити s-підрівень і т.д.
Отже, дописуємо свою електронну формулу. Пам’ятаємо, що у нас є 3 рівні. Кількість е- записуємо над символом підрівня.
Nа +11 ) ) ) 1s2 2s2 2p6 3s1
3. Наступний крок – під кожною дужкою (дужка – це схематичне зображення рівня) вказуємо кількість електронів на ньому
Nа +11 )2 )8 )1 1s2 2s2 2p6 3s1
Електронна формула для атома Na написана
Увага!!!

Графічна формула
- Графічна формула пишеться на основі електронної. Суть в тому, щоб розмістити електрони по комірках (схематичне зображення орбіталей, по яких вони рухаються навколо ядра).
- Щоб навчитися писати графічні формули правильно, потрібно запам’ятати кілька простих правил
- Одна клітинка в зошиті – це одна комірка (орбіталь).
- В одній комірці може бути не більше 2 електронів
- Електрони в комірках позначаємо стрілочками.
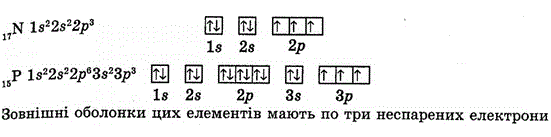
- Важливо! Електрони заповнюються по одному в кожну комірку. Особливо уважним треба бути на р-підрівні – ставимо по одному електрону в кожну комірку, а потім вертаємось до першої. Наприклад. у атома Нітрогену – N чи Р. На 2р-підрівні в цих атомів по 3 електрони – кожен з цих 3-ох електронів зайняв одну комірку.
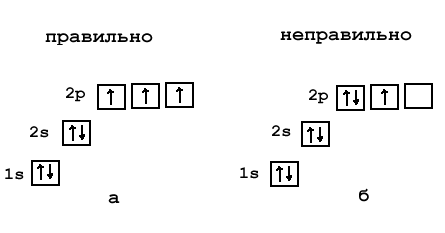
В одній комірці можуть бути електрони лише з різними спінами (тобто стрілочки повернуті вверх і вниз).
Електрони заповнюють комірки попорядку від 1 рівня.
Увага! на 4 рівні після 4s-підрівня заповнюється 3d!! -підрівень, а не 4p. (Згідно з принципом Паулі)
Рівні підносимо на одну клітинку вгору, а підрівні на пів клітинки.
Наприклад,
3. Отже, тепер ми можемо записати графічну формулу для атома Na
Прийом «Це цікаво!!!»
Існують різні способи написання графічних формул, але всі вони підпорядковуються одним і тим же правилам:
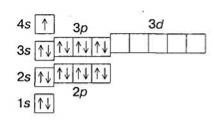 І спосіб
І спосіб
 ІІ спосіб
ІІ спосіб
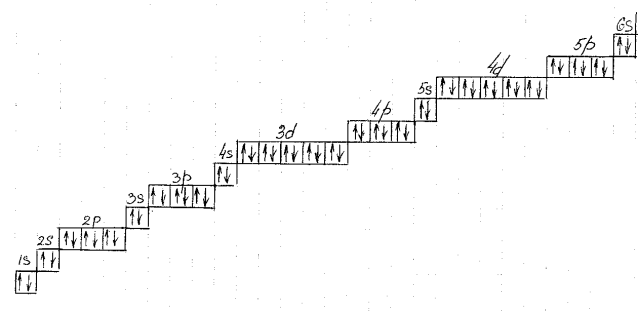 ІІІ спосіб
ІІІ спосіб
V. Закріплення вивченого матеріалу.
Робота в групах. Клас ділиться на 3 групи по рядах. Група, яка виконає завдання першою отримує додатковий бал.
Завдання 1. Складіть електронні й графічні електронні формули атомів хімічних елементів другого періоду.
Завдання 2. Дотримуючись принципу «мінімальної енергії», складіть електронну й графічну електронну формули атома, електронна оболонка якого має шість s-електронів і сім р-електронів. Назвіть елемент, дайте йому характеристику за місцем у періодичній системі.
Завдання 3. Знайдіть і виправте помилки в електронних формулах атомів:
а) 1s22s12p4;
б) 1s12s2;
в) 1s22s12p7.
Завдання 4. Назвіть хімічні елементи, яким відповідають виправлені електронні формули атомів у попередньому завданні.
VI. Підведення підсумків уроку.
Перевірка правильності виконання завдань.
Виставлення оцінок.
VII. Домашнє завдання.
Опрацювати § 2, завдання для самоконтролю 1-4.
Завдання: Складіть електронні й графічні електронні формули атомів хімічних елементів з протонними числами: а) 7 і 15; б) 13 і 16. У кожній парі зазначте спільні і відмінні риси.


про публікацію авторської розробки
Додати розробку
