Урок хімії та біології з теми "Оксиди"
Урок хімії та біології у 8 класі
Дюба Ірина Володимирівна , вчитель хімії Криворізької гімназії № 49
Тема: Сполука, важлива для життя
Мета:Сформувати поняття про оксиди, їх класифікацію за сучасною номенклатурою, ознайомити учнів із значенням оксидів в житті людини, розвивати логічне мислення і навички складання формул бінарних сполук, формувати вміння систематизувати матеріал з курсів хімії та біології, формувати науковий світогляд, інтерес до вивчення предметів природничого циклу.
Обладнання: мультимедійна презентація з теми, задачі міжпредметного змісту, роздатковий матеріал, реактиви для проведення лабораторного досліду.
Тип уроку: комбінований
І. Актуалізація опорних знань
Повідомлення теми уроку.
У 7 класі ми з вами познайомилися зі складними речовинами – оксидами. Давайте пригадаємо, що це за сполуки? Погляньте на слайд. Що спільного у цих сполук? Н2О, СuО, СО, СО2, Fe2O3, N2O5
(складаються з 2-х елементів, один з яких Оксиген).
Записуємо визначення в зошити: Оксиди – бінарні сполуки, до складу яких входить Оксиген у валентності ІІ та ступені окиснення -2.
ІІ. Вивчення нового матеріалу
Як же утворюються назви оксидів? ( робота з підручником автор Ярошенко, с. 155)
Назва елемента, його валентність ( для елементів, що мають змінну валентність), оксид.
Давайте назвемо оксиди на слайді:
Н2О - гідроген оксид
СuО - купрум (ІІ) оксид
СО - карбон (ІІ) оксид
СО2 - карбон (ІV) оксид
Fe2O3 - ферум (ІІІ) оксид
N2O5 – нітроген (V) оксид
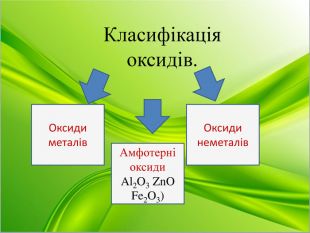
Давайте поглянемо на періодичну систему хімічних елементів. Скажіть, які хімічні елементи там розташовані? ( метали та неметали). Як їх можна розрізнити? ( користуємося довгою формою ПСХЕ)
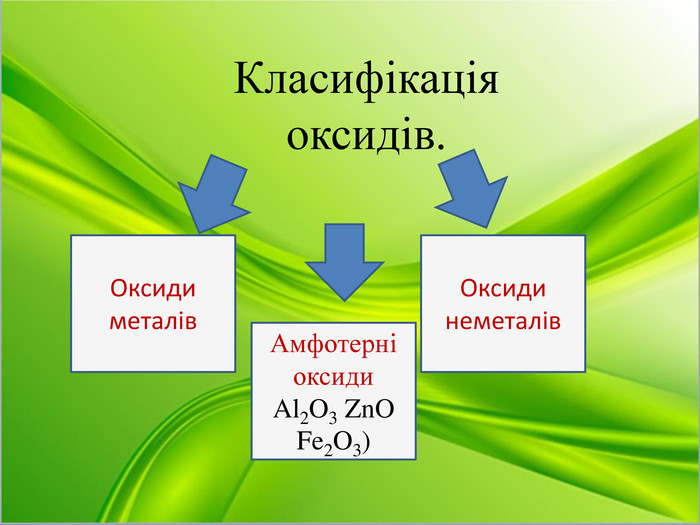
Отже, оксиди класифікують: (схема на слайді)
Оксиди

Пропоную вам
Завдання: записати по 2 приклади оксидів металів та неметалів в зошитах
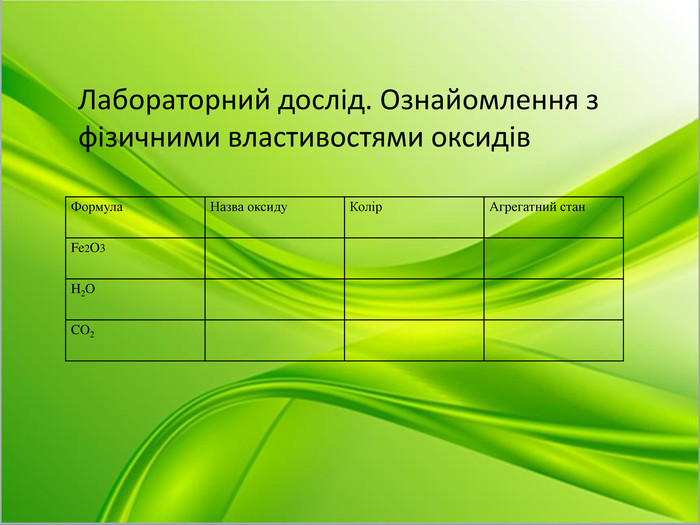
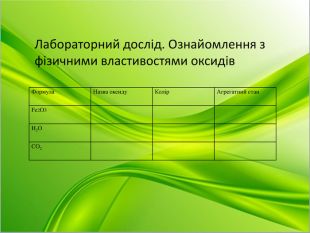
Лабораторний дослід. Ознайомлення з фізичними властивостями оксидів.
(на столах в учнів знаходяться пробірки з оксидами , за інструктивною карткою учні заповнюють таблицю)
Нагадую про правили ТБ під час проведення лабораторного досліду
|
Формула |
Назва оксиду |
Колір |
Агрегатний стан |
Розчинення у воді |
|
СаO |
|
|
|
|
|
H2O |
|
|
|
|
|
CO2 |
|
|
|
|
|
Fe2O3 |
|
|
|
|
Який висновок про фізичні властивості ми можемо зробити? ( мають різний колір, агрегатний стан).
Повідомлення учнів про значення оксидів в природі та життя людини.
Вчитель хімії. Крім оксидів, які ми можемо зустріти в природі, існує дуже важливий оксид, без якого наш організм не може існувати, з ним ви знайомилися на уроці біології. Щоб дізнатися, де він міститься, пропоную переглянути дослід.
(дослід «штучна кров»). Учні відповідають, що це кров, до складу крові входять еритроцити, які містять гемоглобін.
Слово вчителю біології. Для повторення матеріалу, який ми вивчали на минулому уроці, я пропоную пограти в гру «Знайди пару»
(Учні отримують картинки зі складовими крові та відшукують їх назви)
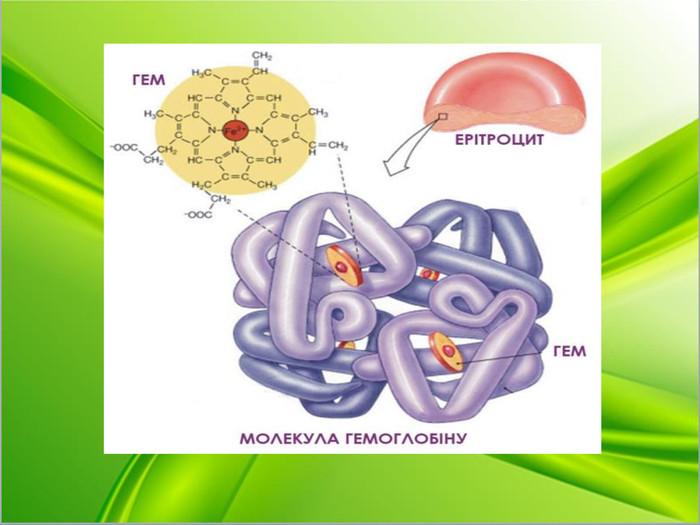
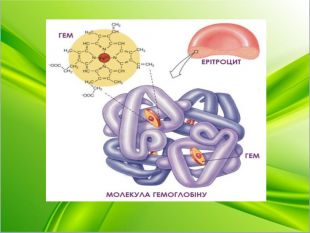
Вчитель хімії. Як ви вже знаєте, до складу еритроцитів входить гемоглобін. Які складові гемоглобіну? Пропоную переглянути слайд. ( на слайді будова гему)
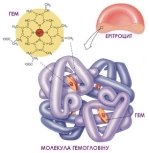
Гемоглобі́н (від грец. haima — кров і лат. globus — куля) — складний залізовмісний білок еритроцитів тварин і людини, здатний оборотно зв'язуватися з киснем, забезпечуючи його перенесення до тканин.
Головна функція гемоглобіну полягає в транспорті дихальних газів. У капілярах легенів в умовах надлишку кисню останній з'єднується з гемоглобіном. Потоком крові еритроцити, що містять молекули гемоглобіну із зв'язаним киснем, доставляються до органів і тканин, де кисню мало; тут необхідний для протікання окислювальних процесів кисень звільняється від зв'язку з гемоглобіном. Крім того, гемоглобін здатний зв'язувати в тканинах невелику кількість діоксиду вуглецю (CO2) і звільняти його у легенях. Монооксид вуглецю (CO) зв'язується з гемоглобіном крові міцніше, ніж кисень, необоротно утворюючи карбоксигемоглобін.
Який же хімізм реакції? ( на слайді)
Hb + O2=HbO2 оксигемоглобін (процес відбувається в легенях)
HbO2 = Hb+O2 Hb+СO2 = HbСO2 (процеси відбуваються в тканинах)
Hb + CO =HbCO карбоксигемоглобін ( процес під час отруєння чадним газом)
ІІІ Узагальнення та систематизація знань учнів.
Вчитель хімії. Пропоную вам до розв’язання цікаві задачі.
- Скільки кисню переносить кров за 1 кругообіг, якщо маса людини 60 кг, кров становить 8% від маси тіла, густина крові 1,050 г/см3, вміст гемоглобіну 14 г\100 мл, 1 г гемоглобіну зв’язує 1,34 мг кисню.
- Обчислити, скільки кисню перенесе 1 еритроцит за своє життя? (додаткові матеріали: 10 еритроцитів містять 15 г гемоглобіну, 1 цикл кровообігу – 23 секунди, 1 доба – 86400 секунд, тривалість життя еритроциту – 125 діб)
Перевірка правильності розв’язків ( на слайді)
Вчитель хімії. В середньому дорослий організм містить 5 млн еритроцитів. Пропоную вам навантажити свої еритроцити порцією кисню та провести дихальні справи.( проводиться валеопауза під музичний супровід)
- «Повітряна кулька» - надування живота ( покрашення вентиляції легенів)
- «Помпа» - вдих через ніс, руки піднімаються до гори, видих через рот
Вчитель біології. У нас пряме включення з травматологічного відділення 8 міської лікарні. ( Репортер описує ситуації, учні обіграють їх, коментується надання першої допомоги під час різних видів кровотеч)
Ситуація 1 - Артеріальна кровотеча передпліччя.
Ситуація 2 - Венозна кровотеча гомілки
Ситуація 3 - Внутрішня кровотеча
Ситуація 4 – Капілярна кровотеча
Вчитель біології. Давайте підсумуємо. Якими бувають кровотечі? Чому для кожної кровотечі свої правила зупинки?
Вчитель хімії. Для закріплення матеріалу я пропоную пройти тест (+ або -)
- Гемоглобін входить до складу лейкоцитів (-)
- Сполука гемоглобіну та кисню – дуже стійка сполука (-)
- Кров складається з формених елементів крові та плазми (+)
- До складу гемоглобіну входить йон Fe 3+ (+)
- Артеріальна кровотеча - яскраво – червона пульсуюча кров (+)
- Формені елементи крові – тромбоцити, лейкоцити, остеоцити (-)
- Оксиди – бінарні сполуки металу та гідрогену (-)
- Сироватка крові – плазма крові без білка фібриногена (+)
- Венозну кровотечу перв´язують вище рани (-)
- Гемоглобін з киснем утворює оксид (+)
Перевірка відповідей учнів (правильні відповіді на слайді)
ІV Підведення підсумків уроку
Вчитель хімії. Отже, сьогодні на уроці ми з вами подивилися на біологічні об’єкти очима хімії. Яка ж сполука важлива для життя людини?
У вас на столах лежать картинки гемоглобіну та еритроцита. Пропоную написати на них - що нового дізналися на уроці та що ще хочете дізнатися з даної теми. ( учні прикріплюють відповіді на дошку)
V Домашнє завдання.
З хімії - § 30 , с 154 № 91 , с158
З біології – підготувати проект
Додаток 1
![]() Дано: Розв’язання
Дано: Розв’язання
10 еритроцитів – 15г Hb 1. Скільки гемоглобіну міститься в 1 еритроциті
1г Hb- 1,34 г O2 10 еритроцитів – 15 г
1доба – 86400 сек 1 еритроцит –х,
1 цикл – 23 сек – 2,01 мг О2 Х=1,5 г
2. Скільки кисню перенесе 1,5 г гемоглобіну
Тривалість життя
еритроциту -125 діб 1г гемоглобіну – 1,34 мг кисню
1,5 г –х
Х=2,01 мг
3. Знаходимо масу кисню, яка переноситься за 1 добу
23 сек – 2,01 мг
86400 – х
Х= 7550,6 мг
4. Знаходимо масу кисню, яку переносить еритроцит за своє життя
7550,6* 125 =943825 мг або 944 г
Відповідь: 944 г
![]() Дано: Розв’язання
Дано: Розв’язання
m=60кг= 60000г 1. Знаходимо масу крові: 60000*0,08=4800(г)
![]() w =8% 2. Знаходимо об'єм крові V = m/ ρ =4800/1,050=4571 мл
w =8% 2. Знаходимо об'єм крові V = m/ ρ =4800/1,050=4571 мл
ρ= 1,050г/см3
m (O2) 3. Знаходимо масу гемоглобіну 100 мл – 14 г
4571 мл –Х
Х=4571*14/100 = 639,94(г)
4. Скільки кисню переноситься за 1 кругообіг
m(О2) = 639,94*1,34 = 857,5 мг
Відповідь: 857,5 мг


про публікацію авторської розробки
Додати розробку