Урок "Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону."
Домашнє завдання за підручником "Хімія (Попель, крикля) 11 клас". Урок підходить і для 9 класу. В матеріалах міститься приклад розв'язування задач на знаходження молекулярної формули органічної речовини.
УРОК № Дата:
ТЕМА: Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електронних орбіталей атома Карбону.
МЕТА: дати класифікацію вуглеводнів; пояснити механізм утворення ковалентних карбон-карбонових зв'язків у органічних сполуках; сформувати вміння розрізняти види гібридизації електронних атомів Карбону; формувати комунікативні навички.
БАЗОВІ ПОНЯТТЯ ТА ТЕРМІНИ: вуглеводні, насичені та ненасичені вуглеводні, карбон-карбоновий звязок, орбіталь.
ТИП УРОКУ: урок вивчення нового матеріалу.
МЕТОДИ НАВЧАННЯ: методи стимулювання й мотивації навчання, пояснювально-ілюстративні, наочні, репродуктивні, частково пошукові, інтерактивні, метод самостійної роботи, стратегії розвитку критичного мислення.
СТРУКТУРА УРОКУ
І. Організаційний етап. 1 хв
ІІ. Мотивація навчання. 4 хв
ІІІ. Актуалізація опорних знань. 5 хв
ІV. Вивчення нового матеріалу. 23 хв
V. Закріплення знань. 7 хв
VІ. Домашнє завдання. 2 хв
VІІ. Підбиття підсумків уроку. 3 хв
ХІД УРОКУ
І. Організаційний етап.
ІІ. Мотивація навчання.
- Що вивчає органічна хімія?
- Які речовини називаються органічними?
- Яку валентність має атом Карбону в органічних сполуках?
ІІІ. Актуалізація опорних знань.
- Надайте класифікацію органічних сполук за вмістом елементів.
- Як класифікуються органічні сполуки за функціональною групою?
- Виходячи з цих двох класифікацій, що ви можите сказати про вуглеводні? (Це иорганічні сполуки, які в своєму складі містять атоми Карбону та Гідрогену, та не мають функціональної групи).
ІV. Вивчення нового матеріалу.
- Класифікація вуглеводнів.
ВУГЛЕВОДНІ СхНу
↓ ↓
Насичені Ненасичені
В карбоновому ланцюзі В карбоновому ланцюзі
тільки одинарні звязки є подвійні та потрійні
С-С С=С С=С
↓ ↓ ↓ ↓ ↓
Алкани Циклоалкани Алкени Алкіни Арени
CnH2n+2 CnH2n CnH2n CnH2n-2 CnH2n-6
всі звязки всі звязки один один ароматичний
одинарні одинарні, подвійний потрійний вуглеводень
але карб.ланцюг звязок звязок
утворює цикл
- Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках.
В органічних сполуках атом Карбону чотиривалентний. Необхідною умовою для цього є перехід атома у збуджений стан. Унаслідок переміщення 2s-електрона у вакантну 2р-орбіталь усі чотири електрони зовнішнього енергетичного рівня стають неспареними:
С → С*
...2s 22р2 → ... 2s 12р3
основний стан збуджений стан
Енергія, яка витрачається на такий перехід, компенсується енергією, що виділяється під час утворення атомом Карбону ковалентних зв'язків.
На малюнку 3 на сторінці 28 підручника можна проспостерігати, що в молекулах вуглеводнів утворюється карбон-карбоновий звязок. Карбон-карбоновий звязок може бути одинарним, подвійним і потрійним.
- Види гібридизації електронних орбіталей атома Карбону.
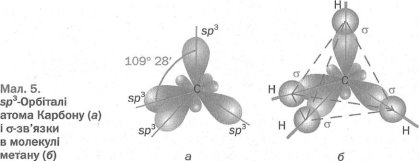
У молекулі метану змінені, або гібридні, орбіталі мають форму об'ємної несиметричної вісімки ( ). Вони зорієнтовані одна щодо одної під кутами 109° 28', тобто у напрямках від центра тетраедра до його вершин (мал. 5, а). Позначення кожної такої орбіталі — sр3; воно складається з позначень вихідних орбіталей та їх кількості. Цей тип гібридизації називають sр3-гібридизацією.
У молекулі метану чотири sр3-орбіталі атома Карбону перекриваються із s-орбіталями атомів Гідрогену (мал. 5,6). Тому молекула метану має форму тетраедра; у його центрі розміщений атом Карбону, а у вершинах — атоми Гідрогену.
Будова молекули етену. У молекулі Н2С=СН2 кожний атом Карбону сполучається з іншим атомом Карбону і двома атомами Гідрогену. Із його чотирьох орбіталей, у яких перебуває по одному зовнішньому електрону, лише три — s-орбіталь і дві р-орбіталі — зазнають гібридизації. Три утворені sр2-орбіталі розміщуються під кутами 120°. Одна з них перекривається з такою самою орбіталлю іншого атома Карбону, а дві — із s-орбіталями двох атомів Гідрогену. Між цими атомами утворюються σ-зв'язки.
Третя р-орбіталь кожного атома Карбону залишається незмінною. Такі орбіталі розміщені перпендикулярно до гібридних орбіталей і перекриваються на двох ділянках — над і під лінією, яка з'єднує центри атомів Карбону (мал. 6,7 стор.30 підручника). У результаті між цими атомами утворюється ще й π-зв'язок.
Отже, подвійний зв'язок у молекулі етену складається із σ-зв'язку і π-зв'язку.
Будова молекули етину. У молекулі НС=СН кожний атом Карбону утворює два σ-зв'язки. У них беруть участь s-електрон і р-електрон. Орбіталі цих електронів зазнають гібридизації і перетворюються на дві гібридні Sр-орбіталі, які розміщуються у просторі під кутом 180° (мал. 8 cтор.31). Одна з них перекривається із s-орбіталлю атома Гідрогену, а друга — з гібридною орбіталлю іншого атома Карбону (мал. 9 cтор.32). Центри всіх атомів молекули С2Н2 розміщені на прямій лінії.
Інші два р-електрони кожного атома Карбону беруть участь в утворенні двох π-зв'язків. Їхні р-орбіталі попарно перекриваються. Ділянки перекривання цих орбіталей перебувають поза лінією, яка з'єднує центри атомів.
Отже, потрійний зв'язок у молекулі етину складається з одного σ-зв'язку і двох π-зв'язків.
V. Закріплення знань.
- Назвіть типи гібридизації орбіталей атома Карбону.
- Задачі:


VІ. Домашнє завдання.
1. §4.
2. стор.35 №29.
VІІ. Підбиття підсумків уроку.


про публікацію авторської розробки
Додати розробку
