Урок "Одноатомні спирти".
Урок містить класифікацію спиртів, номенклатуру, ізомерію одноатомних спиртів, а також інформацію про водневий зв'язок та його вплив на фізичні властивості спиртів.
ТЕМА 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ (22 години)
УРОК № Дата:
ТЕМА: Насичені одноатомні спирти. Ізомерія, номенклатура насичених одноатомних спиртів. Водневий зв’язок, його вплив на фізичні властивості спиртів.
МЕТА: сформувати уявлення про оксигеновмісні органічні сполуки; дати поняття про спирти та їх функціональну групу; ознайомити учнів з представниками спиртів — метанолом, етанолом, навчити записувати їхні молекулярні, електронні та структурні формули; розглянути номенклатуру та ізомерію спиртів; пояснити утворення водневого зв’язку в молекулах спиртів та його вплив на фізичні властивості спиртів.
БАЗОВІ ПОНЯТТЯ ТА ТЕРМІНИ: спирти, гідроксильна група, функціональна група, гомологічний ряд, метанол, етанол, гідрофільна та гідрофобна групи, водневий зв'язок.
ТИП УРОКУ: урок вивчення нового матеріалу.
МЕТОДИ НАВЧАННЯ: словесні, пояснювально-ілюстративні, наочні, репродуктивні, частково пошукові, практичні (розв'язування вправ), інтерактивні.
СТРУКТУРА УРОКУ
І. Організаційний етап. 2 хв
ІІ. Актуалізація опорних знань. 3 хв
IІІ. Вивчення нового матеріалу. 25 хв
ІV. Закріплення знань. 10 хв
V. Домашнє завдання. 2 хв
VІ. Підбиття підсумків уроку. 3 хв
ХІД УРОКУ
І. Організаційний етап.
![]()
![]()
![]() II. Актуалізація опорних знань.
II. Актуалізація опорних знань.
- Які елементи можуть входити до складу органічних сполук?
- Які елементи входять до складу вуглеводнів?
- Які хімічні зв'язки існують між атомами хімічних елементів у вуглеводнях?
- Який заряд (ступінь окиснення) виявляють атоми Карбону та Гідрогену у вуглеводнях?
III. Вивчення нового матеріалу.
1. Оксигеновмісні органічні сполуки (стор.129 підручника).
Оксигеновмісні органічні сполуки
Спирти Альдегіди Карбонові кислоти Естери Вуглеводи
O O
R-OH R-C R-C R-COOR’ Cn(H2O)m
H OH
2. Поняття про спирти.
Спирти — це похідні вуглеводнів, у яких один або кілька атомів Гідрогену заміщені на групу -ОН.
Спирти — це органічні сполуки, в молекулах яких містяться одна або декілька характеристичних гідроксильних груп. Характеристична (функціональна) група зумовлює певні хімічні властивості речовин.
Загальна формула одноатомних спиртів: СnН2n+1ОН або СnН2n+2O. Перша із цих формул показує, що спирти можна вважати похідними вуглеводнів, у молекулах яких один атом Гідрогену замінений гідроксильною групою, а друга — що склад спиртів і алканів відрізняється лише наявністю атома Оксигену (спирти навіть іноді називають оксидами алканів).
Будова – sp3-гібридизація, утворюються σ-звязки.
Номенклатура: суфікс –ол.
Гомологічний ряд одноатомних спиртів:
Спирти(за будовою вуглеводневого ланцюга)
Насичені Ненасичені Ароматичні
СН3-СН2-ОН СН2=СН-СН2-ОН
етанол аліловий спирт
фенол
Спирти(за кількістю гідроксогруп)
Одноатомні Двоатомні(Гліколі) Триатомні Багатоатомні
СН3-СН2-ОН СН2-СН2 СН2-ОН
ОН ОН СН2-ОН
СН2-ОН
етанол етан-1,2-діол пропан-1,2,3-тріол циклогексан-
1,2,3,4,5,6-гексаол
(гліцерол) (інозит)
Спирти(за типом атома Карбону)
Первинні Вторинні Третинні
3 2 1 4 3 2 1 1 2 3 4 5 6
СН3-СН2-СН2-ОН СН3-СН2-СН-СН3 СН3-СН2-СН-СН2-СН2-СН3
ОН ОН
пропан-1-ол бутан-2-ол гексан-3-ол
Ізомерія:
- карбонового ланцюга:
С4Н9ОН бутан-1-ол
СН3
СН3-СН2-СН2-СН2-ОН СН3-СН-СН2-ОН СН3-С-ОН
СН3 СН3
бутан-1-ол 2-метилпропан-1-ол 2,2-диметилетан-2-ол
- положення гідроксильної групи:
СН3-СН2-СН2-СН2-ОН СН3-СН-СН2-СН3
ОН
бутан-1-ол бутан-2-ол
- міжгрупова (міжкласова):
С4Н9ОН бутан-1-ол
СН3-СН2-СН2-СН2-ОН СН3-СН2-О-СН2-СН3 СН3-О-СН2-СН2-СН3
бутан-1-ол діетиловий етер метилпропіловий етер
3. Фізичні властивості спиртів
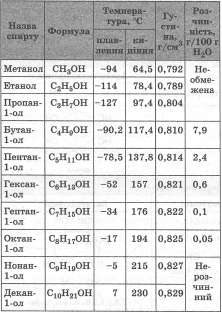
У гомологічному ряду одноатомних спиртів немає газуватих речовин. Перші члени гомологічного ряду — це рідини, а вищі спирти (від С15) - тверді речовини. У гомологічному ряду нормальних (нерозгалужених) спиртів зі збільшенням молекулярної маси збільшуються температури плавлення й кипіння. Густина спиртів майже не змінюється. Розчинність у воді при цьому погіршується, хоча перші три члени гомологічного ряду змішуються з водою необмежено. Тверді спирти не мають запаху, у той час як рідкі спирти мають специфічні запахи. При цьому метанол та етанол за запахом дуже схожі й відрізнити їх дуже складно.
Щодо загальних фізичних властивостей багатоатомних спиртів слід відзначити, що це в'язкі речовини, добре розчинні у воді й погано розчинні в органічних розчинниках. За рахунок більшого числа можливих водневих зв'язків багатоатомні спирти мають більшу в'язкість, більшу температуру плавлення та кипіння й кращу розчинність порівняно з їхніми одноатомними аналогами.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 4. Водневий звязок в молекулах спиртів.
4. Водневий звязок в молекулах спиртів.
Відсутність серед спиртів газуватих речовин пояснюється тим, що електронна будова спиртів нагадує електронну будову води, що обумовлює можливість утворення водневого зв'язку між молекулами спиртів.
Завдяки водневому зв’язку молекули спиртів, так само як і молекул води, асоційовані: між ними існує додаткова міжмолекулярна взаємодія.
Утворенням водневих зв'язків з молекулами води пояснюється розчинність спиртів. Молекули спиртів складаються ніби з двох частин — розчинної у воді (гідрофільної), яка містить гідроксильну групу, та нерозчинної (гідрофобної), що складається з вуглеводневого радикала. Якщо вуглеводневий радикал невеликий, то водневі зв'язки гідроксильної групи з молекулами води спроможні втримати молекулу спирту в розчині. Якщо ж молекула спирту має довгий вуглеводневий ланцюг, який «чинить опір» розчиненню, то гідроксильна група вже не в змозі здійснити розчинення речовини.
IV. Закріплення знань.
Виконання завдань.
-






 Із наведеного переліку виберіть формули, які можуть відображати склад насичених одноатомних спиртів: С5Н10О, С6Н11О6, С6Н12О, С2Н4О, С2Н6О2, С2Н6О.
Із наведеного переліку виберіть формули, які можуть відображати склад насичених одноатомних спиртів: С5Н10О, С6Н11О6, С6Н12О, С2Н4О, С2Н6О2, С2Н6О.
- Запишіть формули спиртів у порядку зменшення їхньої розчинності: С7Н15ОН, С5Н11ОН, СН3ОН, С4Н9ОН, С6Н13ОН.
- Напишіть структурні формули молекул усіх ізомерних спиртів складу С6Н14О. Назвіть сполуки, укажіть первинні, вторинні і третинні спирти.
V. Домашнє завдання.
VI. Підбиття підсумків уроку.
-
Дякую за урок!

про публікацію авторської розробки
Додати розробку
