Урок "Рівняння стану ідеального газу. Ізопроцеси "
Урок 58. 10 клас
Тема. Рівняння стану ідеального газу. Ізопроцеси
Мета уроку: встановити залежність між параметрами, які визначають стан газу, сформувати знання учнів про газові закони та вміння пояснювати їх з молекулярної точки зору;
формувати пізнавальний інтерес та розширювати політехнічний кругозір учнів;
розвивати критичне мислення.
Тип уроку: урок вивчення нового матеріалу.
Обладнання: портрет Д. І. Менделєєва, комп’ютер, презентація ,,Так - ні“ (вправа до уроку), відео ,,Ізопроцеси в газах“ (тривалість 12хв21с)
(https://www.youtube.com/watch?v=yLiC70R2Q1A)
Хід уроку
I. Організаційний момент
1. Привітання, інформація чергового про відсутніх учнів на уроці.
2. Налаштування на урок
Вправа ,,Абетка добра“ (газ)
Учень:
Г – гарний
А – активний
З – завзятий
ІІ. Актуалізація знань
1. Вправа ,,Так - ні“ з допомогою інтерактивної презентації.
- Газ – агрегатний стан речовини. (Так)
- Гази складаються із частинок, які мають ближній порядок у розташуванні. (Ні)
- Гази зберігають власну форму. (Ні)
- Для рідин і газів властива значна текучість. (Так)
- Об’єктом вивчення у МКТ є ідеальний газ. (Так)
- Ідеальний газ – це газ, в якому взаємодією між молекулами можна знехтувати. (Так)
- Тиск, об’єм температура – не є термодинамічними параметрами. (Ні)
- Для рідин і газів виконуються закони Паскаля і Архімеда. (Так)
- Основне рівняння МКТ не пов’язує мікро- і макропараметри, що характеризують стан газу. (Ні)
IІІ. Мотивація навчальної діяльності
Ні один термодинамічний параметр неможна змінити, не змінюючи один, а то і два інших параметри. Основне рівняння МКТ пов’язує мікро- і макропараметри, що характеризують стан газу. Постає питання: чи можна знайти загальну залежність (формулу), що пов’язує всі три макроскопічні величини (р, Т, V), які характеризують стан ідеального газу. Таку залежність, яку назвали ,,Рівняння стану ідеального газу“ було встановлено незалежно один від одного Д.І.Менделєєвим та Клапейроном
Отже, тема уроку: ,,Рівняння стану ідеального газу. Ізопроцеси “.
IV. Вивчення нового матеріалу
1. Рівняння стану ідеального газу (§ 30)
р = пкТ,
n =N/V =m/M·NA·k.
Тоді отримаємо:
pV = m/M·kNAT.
Добуток сталої Больцмана та сталої Авогадро називають універсальною (молярною) газовою сталою та позначають літерою R
R = kNА, R = 8,31![]()
Отже, цю залежність можна записати рівнянням:
pV = m/M·RT (1)
Але m/M=ν
·pV = ν·RT
Якщо ν=1 моль, то pV = RT (2)
Рівняння стану у вигляді (2) називається рівнянням Клапейрона (1799-1864).
Клапейрон – французький фізик, який протягом 10 років працював у Росії.
Рівняння стану у вигляді (1) уперше було отримано видатним російським вченим Д. І. Менделєєвим. Тому це рівняння називають рівнянням Менделєєва-Клапейрона.
2. Рівняння Клапейрона
pV = RT
![]() = R= const
= R= const
3. Ізопроцеси
- Ізопроцеси - процеси, які відбуваються при незмінному значенні одного із параметрів.
- Газовий закон – кількісна залежність між двома термодинамічними параметрами газу при фіксованому значенні третього.
- Газових законів, як і ізопроцесів – три.
4. Ізотермічний процес (фрагмент 1 відео)
- Ізотермічний процес – процес зміни стану термодинамічної системи при сталій температурі.
- Для ідеального газу ізотермічний процес описується законом Бойля-Маріотта.
Закон встановлено експериментально до створення молекулярно-кінетичної теорії газів англійським фізиком Робертом Бойлем у 1662 році та французьким абатом Едмоном Маріоттом, який описав незалежно від Бойля аналогічні досліди 1676 році.
Закон Бойля-Маріотта (ізотермічний процес, T=const)
![]()
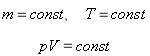
Для газу даної маси при сталій температурі добуток тиску на об’єм сталий.
- Графічне зображення ізотермічного процесу (с.181 підручника)
5. Ізобарний процес (фрагмент 2 відео)
- Ізобарний процес – процес зміни стану термодинамічної системи при сталому тиску.
- Для ідеального газу ізобарний процес описується законом Гей-Люссака.
Закон встановлений в 1802 році французьким фізиком Гей-Люссаком, який визначав об’єм газу при різних значеннях температур в межах від точки кипіння води. Газ тримали в балончику, а в трубці знаходилась крапля ртуті, що закривала газ, який розміщувався горизонтально.
- Закон Гей-Люссака (ізобарний процес, p=const)
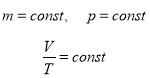
Для газу даної маси при сталому тиску відношення об’єму до температури є сталою величиною.
- Графічне зображення ізобарного процесу (с.182 підручника)
6. Ізохорний процес (фрагмент 3 відео)
- Ізохорний процес – процес зміни стану термодинамічної системи, що протікає при сталому об’ємі.
- Для ідеального газу ізохорний процес описується законом Шарля.
В 1787 році французький вчений Жак Шарль виміряв тиск різних газів при нагріванні при сталому об’ємі і встановив лінійну залежність тиску від температури, але не публікував дослідження. Через 15 років до таких же результатів прийшов і Гей-Люссак і, будучи на рідкість благородним, настояв, щоб закон називався на честь Шарля.
- Закон Шарля (ізохорний процес, V=const)
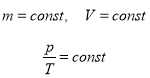
Для газу даної маси при сталому об’ємі відношення тиску до температури є величиною сталою.
- Графічне зображення ізохорного процесу (с.183 підручника)
7. Історична довідка
Вісторії фізики ці відкриття були зроблені в зворотному порядку: спочатку експериментально було отримано газові закони, і лише потім вони були узагальнені в рівняння стану. Цей шлях зайняв майже 200 років: перший газовий закон було отримано у 1662 році фізиками Бойлем та Маріоттом, рівняння стану – в 1834 році Клапейроном, а більш загальна форма рівняння – в 1874 році Д.І.Менделєєвим.
V. Закріплення матеріалу
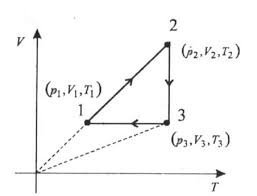
Дано графік зміни стану ідеального газу. Назвати процеси переходу 1 – 2 – 3 – 1.
![]()
VІ. Рефлексія
Інтерактивна вправа ,,3-2-1“
Назвати
3 моменти уроку, які дійсно зацікавили вас на уроці;
2 положення, які хотілося б поглибити;
1 положення, яке ви будете використовувати в практичній роботі
VІІ. Домашнє завдання
1. Знати теоретичний матеріал § 30.
2. Вправа №30(1)


про публікацію авторської розробки
Додати розробку
