Урок "Швидкість хімічної реакції"
___ Клас: 9 Дата:_______
Тема: Швидкість хімічної реакції. Залежність чинників від різних факторів.
Цілі:
Формування ключових компетентностей:
комунікативна
математична грамотність
технологічна
уміння вчитись впродовж життя
Формування предметних компетентностей:
Формувати знання про швидкість хімічної реакції і причини, від яких вона залежить
Розвивати хімічну мову, виховувати інтерес до хімії.
Обладнання: мультимедійний проектор, комп’ютер
Форма роботи: бесіда, розповідь, демонстрація, лабораторна робота, прийом закінчи речення
Хід уроку
- Організаційний етап
- Оголошення теми і мети уроку
- Актуалізація опорних знань
1. два учні працюють з карточками біля дошки
|
Картка 1 Скласти окисно-відновний баланс К+СІ2=КСІ |
Картка 2 Визначити ступінь окиснення в сполуках NaCI, CaCI2, Na2SO4, BaSO4,O2, Na2O |
- Фронтальне опитування
Що таке окисно-відновні реакції
Що таке окисник, що таке відновник
Чому дорівнює ступінь окиснення простої речовини
Чому дорівнює ступінь окиснення Оксигену, окрім винятків Na2O2, OF2
Чому дорівнює ступінь окиснення Гідрогену в більшості сполук, окрім гідридів NaH
Чому дорівнює сума всіх ступенів окиснення у сполуці
Чому дорівнює вищій ступінь окиснення металічного елементу
Чому дорівнює вищій ступінь окиснення неметалічного елементу
Чому дорівнює нижчий ступінь окиснення неметалічного елементу
Мотивація навчальної діяльності
Вивчаючи хімічні властивості речовин і спостерігаючи за процесами в природі, ви, напевно, звернули увагу на те, що різні реакції відбуваються протягом різного часу. Презентація
Усі ці реакції перебігають з різними швидкостями.
Швидкість хімічної реакції – це фізична величина, яка дорівнює відношенню зміни утвореної або витраченої кількості речовини до певного проміжку часу
v=Δn/Δt
Одиницею вимірювання швидкості хімічної реакції є моль/с.
Чим більша зміна кількості речовини чим менше час, за який відбулася ця зміна, тим вища швидкість реакції. Спочатку швидкість реакції найбільша, але з часом вона знижується, оскільки зменшується кількість речовини реагентів.
Швидкість хімічної реакції залежить від багатьох чинників
Інструктаж зБЖД.
Лабораторний дослід №5 (додаток 1)
Залежність швидкості реакції від різних чинників.
Мета: дослідити вплив різних чинників на швидкість хімічної реакції.
Обладнання: гранули Zn, Cu , АІ, розведений розчин хлоридної кислоти (HCl), концентрований розчин хлоридної кислоти, шматок крейди, порошок крейди, спиртівка, сірники, тримач.
Можливі такі варіанти проведення лабораторного досліду:
- Практичне виконання (при наявності реактивів)
- Віртуальне виконання (перегляд відео дослідів)
А.Лавузьє –чудовий експериментатор і тонкий спостерігач,
заповів майбутнім експериментаторам :
- Намагайся робити добре, а не робити багато.
- Спрощуй досліди, наскільки це можливо.
- Ніколи не заповнюйте поспішними висновками мовчання фактів.
Хід роботи
Дослід 1. Вплив природи реагуючих речовин на швидкість хімічної реакції.
В дві пробірки киньте гранулу міді, алюмінію. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як впливає природа реагуючих речовин на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 2. Вплив площі поверхні стикання речовин на швидкість хімічної реакції.
В одну пробірку киньте шматочок крейди, а в іншу пробірку насипте стільки ж порошку крейди. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як ступінь подрібнення речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 3.Вплив концентрації речовин на швидкість хімічної реакції
В дві пробірки киньте однакові гранули цинку. В першу пробірку налийте розведений розчин хлоридної кислоти, а в другу – концентрований розчин хлоридної кислоти. Зробіть висновки, як концентрація речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 4. Вплив температури на швидкість реакції
В дві пробірки киньте однакові гранули цинку. В кожну пробірку долийте розчин хлоридної кислоти. Одну з пробірок підігрійте в полум’ї спиртівки. Зробіть висновок, як температура впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Правило Вант-Гоффа При збільшенні температури на кожні 10 градусів константа швидкості гомогенної елементарної реакції збільшується у два-чотири рази.
Як зміниться швидкість реакції при підвищенні температури від 60º до 90º при температурнім коефіцієнті, який дорівнює 4?
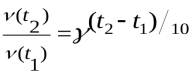 .
.
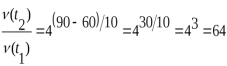
Як зміниться швидкість реакції при підвищенні температури від 60º до 90º при температурнім коефіцієнті, який дорівнює 2?Відповідь 8
|
Фактори, які впливають на швидкість реакції |
Хімічний експеримент, спостереження |
Висновок |
|
Природа реагуючих речовин |
2АI + 6HCl → 2AICl3 + 3H2 – |
Чим активніша речовина, яка вступає в реакцію, тим швидше відбувається реакція |
|
Ступінь подрібнення речовини |
СаСО3 шматок + 2HСl → CaCl2 + CO2 + H2O реакція відбувається повільно
СаСО3 порошок + 2HСl → CaCl2 + CO2 + H2O реакція відбувається швидко |
Чим більша поверхня стикання реагентів, тим більша швидкість реакції |
|
Концентрація реагуючих речовин. |
Zn + 2HClрозвед. → ZnCl2 + H2 – відбувається повільно
Zn + 2HCl концентр. → ZnCl2 + H2 – відбувається швидко
|
Чим більша концентрація реагуючих речовин, тим швидше відбувається реакція. |
|
Температура |
Zn + 2HCl . → ZnCl2 + H2 – відбувається повільно t Zn + 2HCl. → ZnCl2 + H2 – відбувається швидко
|
При нагріванні швидкість реакції зростає. |
|
Наявність каталізатора або інгібітора |
Відео досліди:
|
Каталізатори – прискорюють швидкість реакції Інгібітори - сповільнюють швидкість реакції
|
Робота в групах, після закінчення роботи формулюють висновки формулюють висновки
1 група пояснює, як впливає на швидкість хім. реакції природа
вихідних речовин на прикладі взаємодії магнію, заліза с хлоридною кислотою.
2 група пояснює, як впливає на швидкість хім. реакції ступінь подрібнення речовин на прикладі цукру подрібненого та цукру в брикетах.
Робота біля дошки (Задача)
Як зміниться швидкість реакції при підвищенні температури від 60º до 90º при температурнім коефіцієнті, який дорівнює 2?Відповідь 8
Гра «Вірю – не вірю»
Учні зачитують твердження і дають відповідь - вірне воно чи хибне.
- Речовина, що збільшує швидкість хімічної реакції, але не входить до складу продуктів реакції, називається каталізатором
- Чим хімічно активніші речовини, тим швидше вони вступають у взаємодії
- Швидкість реакції істотно залежить від концентрації реагентів
- Каталізатор не змінює швидкість хімічної реакції
- Швидкість більшості реакцій за участю твердих речовин підвищується у разі їх подрібнення
- Швидкість більшості реакцій зменшується з підвищенням температури
Домашнє завдання:
§ 20
Творче завдання:
Підготувати повідомлення за темами:
- Значення каталізаторів у техніці.
- Ферменти. Інгібітори
|
Картка 1 Скласти окисно-відновний баланс К+СІ2=КСІ |
Картка 2 Визначити ступінь окиснення в сполуках NaCI, CaCI2, Na2SO4, BaSO4,O2, Na2O, Н2SO4 |
Інструктивна картка
Лабораторний дослід
Залежність швидкості реакції від різних чинників.
Мета: дослідити вплив різних чинників на швидкість хімічної реакції.
Обладнання: гранули AI, Zn, Cu , розведений розчин хлоридної кислоти (HCl), концентрований розчин хлоридної кислоти, шматок крейди, порошок крейди, спиртівка, сірники, тримач.
Неухильно виконуйте правила техніки безпеки
Хід роботи
Дослід 1. Вплив природи реагуючих речовин на швидкість хімічної реакції.
В дві пробірки киньте гранулу міді, алюмінію. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як впливає природа реагуючих речовин на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 2. Вплив площі поверхні стикання речовин на швидкість хімічної реакції.
В одну пробірку киньте шматочок крейди, а в іншу пробірку насипте стільки ж порошку крейди. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як ступінь подрібнення речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 3.Вплив концентрації речовин на швидкість хімічної реакції
В дві пробірки киньте однакові гранули цинку. В першу пробірку налийте розведений розчин хлоридної кислоти, а в другу – концентрований розчин хлоридної кислоти. Зробіть висновки, як концентрація речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 4. Вплив температури на швидкість реакції
В дві пробірки киньте однакові гранули цинку. В кожну пробірку долийте розчин хлоридної кислоти. Одну з пробірок підігрійте в полум’ї спиртівки. Зробіть висновок, як температура впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 5. Вплив каталізатора на швидкість хімічної реакції.
|
Фактори, які впливають на швидкість реакції |
Хімічний експеримент, спостереження |
Висновок |
|
Природа реагуючих речовин |
|
|
|
Ступінь подрібнення речовини |
|
|
|
Концентрація реагуючих речовин. |
|
|
|
Температура |
|
|
|
Наявність каталізатора або інгібітора |
|
|


про публікацію авторської розробки
Додати розробку
