Урок в 7 класі на тему: "Хімічні рівняння"
|
|
Я до всього справу маю: Ґрунт у полі удобряю. Урожай оберігаю, Я перу і прибираю, Я годую й одягаю, І метал я добуваю, Я лікую й зберігаю, Я будую і освітлюю І у космос я літаю. А запитання моє: Відгадайте хто я є? |
Тема уроку: « Хімічні рівняння»
Конспект вчителя вищої категорії школи І-ІІІ ступенів №29 м.Києва Малярчук Марії Андріївни
|
|
Не в кількості знань полягає освіта, а в повному розумінні та вмілому застосування всього того, що знаєш.
Дістервег |
Сторінка з листа В.М. Ломоносова,в який учений уперше повідомляє світові про своє відкриття:
« Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного телa отнимется, столько лет присовокупится к другому. Так ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет…»
5.07.1748 г.
Проаналізуйте текст і повідомте класові про це відкриття сучасною українською мовою.
Мета:
- поглибити і розширити знання учнів про хімічні реакції;
- продовжити формування поняття про хімічне рівняння як умовне зображення хімічної реакції;
- формувати вміння і навички складання рівнянь хімічної реакції розміщення коефіцієнтів на основі закону збереження мас,читання хімічних рівнянь;
- удосконалювати навички роботи з хімічним устаткуванням і хімічними реактивами;
- дати уявлення про класифікацію рівнянь реакцій за кількістю вихідних речовин і продуктів реакції.
|
Тип уроку: |
комбінований. |
|
Методи: |
пояснювально-ілюстративні - бесіда, розповідь; практичні – виконання вправ; репродуктивні, частково пошукові.
|
|
Обладнання: |
періодична система хімічних елементів, пробірки, штатив, реактиви.
|
Хронометраж уроку:
|
І. Організаційний етап |
1 хв. |
|
ІІ. Перевірка домашнього завдання |
5 хв. |
|
ІІІ. Актуалізація опорних знань учнів |
5 хв. |
|
ІV. Вивчення нового матеріалу
|
15 хв. |
|
V. Узагальнення та систематизація знань учнів |
16 хв. |
|
VІ. Домашнє завдання |
1 хв. |
|
VІ. Підбиття підсумків уроку |
2 хв. |
Хід уроку
І. Організаційний етап.
Привітання, перевірки готовності учнів до уроку.
ІІ. Перевірка домашнього завдання.
Урок 19. Завдання №3.
- Визначити масу цинк хлориду,яка утворилася при взаємодії13г цинку і 14,2 г хлору.
|
Дано: m(Zn) – 13 г. m(Cl2) – 14,2 г. |
За законом збереження маси речовини: m(ZnCl2) = m (Zn) + m (Cl2) m (ZnCl2) = 13г.+14,2= 27,2 г. m (ZnCl2) =27,2 г.
Відповідь: маса цинк хлориду дорівнює 27,2 г. |
|
m(ZnCl2) – ? |
- Сформуйте закон збереження маси речовини.
Маса речовини, що вступила в хімічну реакцію, дорівнює масі речовини, що утворилася в результаті реакції.
- Коли і ким був відкритий цей закон? ( 1748 р. М.Ломоносовим, 1789 р. А. Лавуазьє)
- Отже: в чому полягає сутність хімічної реакції? (перетворення речовин)
- Що відбувається з атомами під час хімічної реакції? ( перегруповуються)
- Як?
Пишемо рівняння реакції. Записувати хімічну реакцію можна по-різному. Наприклад: цинк + хлор → цинк хлорид. Але такий запис не вказує хімічний склад реагентів і продуктів і тим паче не вказує як перегруповуються атоми. Тому існує інший запис хімічної реакції, де замість назви речовин містяться хімічні формули: Zn + Cl2 →ZnCl2
- Що таке хімічне рівняння?
Це умовне зображення хімічної реакції за допомогою формули та коефіцієнтів. Складається з :
|
Лівої частини Речовини до реакції Вихідні речовини |
→
|
Правої частини речовини після реакції продукти реакції
|
ІІІ. Актуалізація опорних знань учнів
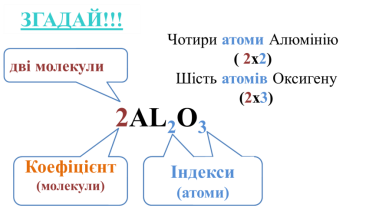
- Що таке коефіцієнт?
Число перед хімічною формулою, що показує кількість молекул речовини:
- Що таке хімічна формула?
Умовний запис складу речовин за допомогою хімічних знаків та індексів.
- Що таке індекс?
Число, яке показує кількість атомів, що входять до складу речовини.

ІV. Вивчення нового матеріалу
- Рівняння хімічних реакцій
Відповідно до закону збереження маси речовини число атомів різних елементів до хімічної реакції дорівнює числу атомів елементів після реакції.
Це має бути відображено в схемі хімічної реакції, тоді вона стає хімічним рівнянням.
Число атомів змінюють за допомогою коефіцієнтів.
Отже, хімічне рівняння – це умовний запис хімічної реакції за допомогою хімічних формул та коефіцієнтів.
Урок 20 завд. 2
|
4P+ |
5O2= |
2P2O5 |
|
4 атоми Фосфору ( 4х1) |
10 атомів Оксигену (5х2) |
4 атоми Фосфору (2х2) 10 атомів Оксигену (2х5) |
|
4 |
10 |
4+10 |
|
14= |
14 |
|
Висновок: число атомів у лівій частині реакції дорівнює числу атомів у правій. Цим обумовлена рівність мас речовин і є доказом правильності розташування коефіцієнтів.
- Яка загальна кількість коефіцієнтів? (11)
- Правила написання хімічних рівнянь
Не можна:
- Ставити коефіцієнти в середину формули:
Н2+O2→H22O2
- Змінювати індекси у формулі:
Н2+O2→H2O2
- Ставити коефіцієнти у кілька разів більше:
4Н2+2O2→4H2O2
Алгоритм розстановки коефіцієнтів у хімічних рівняннях.
|
Zn+O2→ZnO 2Zn+O2=2ZnO |
|
CH4+O2→CO2+H2O CH4+2O2=CO2+2H2O |
|
Fe+Cl2→FeCl3 2Fe+3Cl2=2FeCl3 |
|
CO+O2→CO2 2CO+O2=2CO2 |
|
C2H2+O2→ CO2+ H2O 2C2H2+5O2=4CO2+ 2H2O |
|
NaOH+Al2(SO4)3→Al(OH)3+Na2SO4 6NaOH+Al2(SO4)3=2Al(OH)3+3Na2SO4 |
- Типи хімічних реакцій.
Учні по ланцюжку розставляють коефіцієнти
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Проблемне питання: за якою ознакою можна розділити наведені реакції на групи?
Група І – одна вихідна речовина → кілька продуктів
Група ІІ – кілька вихідних речовин → один продукт
До них ще додають реакції заміщення і обміну.
|
Типи хімічних реакцій |
|||
|
↓ |
↓ |
↓ |
↓ |
|
сполучення |
розкладу |
заміщення |
обміну |
|
А+B→AB |
AB →А+B |
АB+C→AC+B |
АB+CD→AD+CB |
|
Сполучення |
|
|
Розкладу |
|
|
Заміщення |
|
|
Обміну |
|
V. Узагальнення та систематизація знань учнів
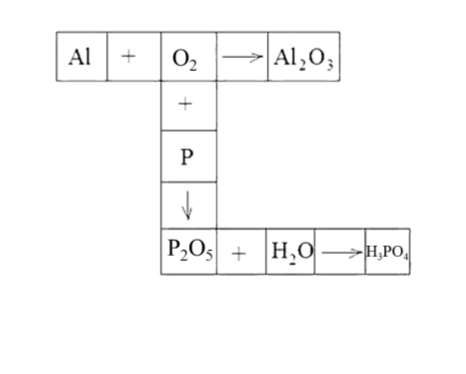
1. Доберіть символи пропущених хімічних елементів та розставте коефіцієнти:
2.Вибери рівняння реакцій:
3. 2Ca+O2 = 2CaO
2. 4Fe +3O2=2Fe2O3
1. 2Cu+ O2 =2CuO
3. Ca +2 H2O =Ca(OH)2 +H2
4. CaO +H2O =Ca(OH)2
1. CuO +2HCl =CuCl2+H2O
3. H2CO3 =H2 O +CO2
3. Fe2O3+ 2Al = Al2O3+2Fe
3. CuO +H2 =Cu +H2O
2. Ca(OH)2 +2 HNO3= Ca(NO3)2 +2 H2O
1. V2O5 +5CO =2V +5CO2
1. FeCl3 +3 NaOH =Fe(OH)3 +3NaCl
2. Ca(OH)2 +2HCl = CaCl2 +2H2O
3. Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
2. BaCl2 + K2SO4 = BaSO4+2 KCl
2. K2SiO3 + H2SO4 = K2SO4 +H2SiO3
1. Na2O + 2HNO3 =2NaNO3 +H2O
1. C2H4+2 O2 =2CO2 + 2H2O
4. CuSO4 + 2NaOH =Cu(OH)2 +Na2SO4
2. CuCl2 +H2SO4 = CuSO4 +2HCl
VІ. Домашнє завдання
Підготуватися до тематичної роботи. Повторити уроки 13-21, §11-15
VІ. Підбиття підсумків уроку



про публікацію авторської розробки
Додати розробку
