Урок "Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів"
- Валентність.docx docx
- Валентність.pptx pptx
Тема: Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів.
Мета: сформувати в учнів поняття валентність як властивість атомів хімічного елемента приєднувати певну кількість атомів інших елементів; познайомити з поняттями «стала» та «змінна» валентність; навчити складати формули речовин із двох елементів за їх валентністю.
Очікувані результати: учень розуміє і може пояснити, що таке валентність; може назвати хімічні елементи з постійною або сталою валентністю; складає формули бінарних сполук за валентністю елементів
Ключові компетентності: Спілкування державною мовою , математична компетентність, основні компетентності у природничих науках і технологіях, ініціативність і підприємливість, соціальна та громадянська компетентності
Тип уроку: засвоєння нових знань
Обладнання: ноутбук, мультимедіапроектор, дошка.
Основні поняття і терміни: валентність, одновалентні елементи, двовалентні елементи, тривалентні елементи, чотиривалентні елементи, п’ятивалентні елементи, шестивалентні елементи, семивалентні елементи, стала валентність, змінна валентність.
Хід уроку
І. Організаційний етап (Слайд 3)
Доброго дня. Рада вас бачити, сьогодні на вас чекає незвичайний, цікавий матеріал, і я вірю, що ви впораєтесь. Тому всім нам успіхів!
ІІ. Актуалізація опорних знань (бесіда) (Слайд 4)
- Що показує хімічна формула?
- Спробуйте в зошитах записати формули речовин, до складу яких входять: (Слайд 5)
А) атом Феруму і три атоми Хлору
Б) два атоми Алюмінію і три атоми Оксигену
В) атом Кальцію, атом Карбону і три атоми Оксигену.
3) Чи можуть ці хімічні формули мати інший вигляд, тобто буде інша кількість атомів кожного елемента?
ІІІ. Пояснення нового матеріалу
Запишіть в зошиті хімічні формули : HCl, H2O, NH3, CH4
Зверніть увагу, що атоми Хлору, Оксигену, Нітрогену, Карбону приєднують тільки певну кількість атомів Гідрогену. Такі властивості мають і інші елементи у різних сполуках і ця властивість має назву валентність.
Отже, Вале́нтність — це властивість атомів одного хімічного елемента з'єднуватися з певним числом атомів інших хімічних елементів. (Слайд 6)
Валентність у формулах можна позначити римськими цифрами, які записують над символами хімічних елементів. Валентність має кількісну характеристику. За одиницю прийнято валентність атома Гідрогену. Атом Гідрогену не приєднує більше одного атома інших елементів. Отже, Гідроген одновалентний.
У записаних формулах розставимо валентність:
І І І ІІ ІІІ І ІV I
HCl H2O NH3 CH4
Проте, Гідроген не утворює сполук із усіма елементами, тому валентність елементів можна визначити ще за Оксигеном. Оксиген у сполуках завжди двохвалентний. Це стала валентість. Визначимо валентість за Оксигеном:
HgO Cu2O NO2 Al2O3 P2O5
Алгоритм визначення валентності: (Слайд 7)
- Позначаємо відому валентність елемента:
ІІ
HgO
- Множимо валентість елемента на його кількість атомів:
ІІ
HgO ІІ *1=2
- Отримане число ділимо на кількість атомів іншого елемента, валентність якого ми шукаємо:
ІІ
HgO 2/1=2
- Отримане число це і є валентність яку, ми шукаємо:
ІІ ІІ
HgO
За цим алгоритмом визначаємо валентності усіх елементів. (Слайд 8)
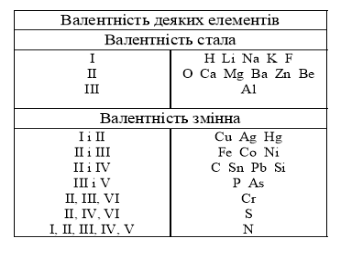
Деяким хімічним елементам притаманна стала валентність, ми познайомились з валентністю Гідрогену та Оксигену. Це елементи зі сталою, тобто постійною валентністю. Деякі елементи мають змінну валентність, вона залежить від багатьох факторів, наприклад, з яким хімічним елементом утворюється хімічний зв’язок.
В зошити записати таблицю елементів з постійною та сталою валентністю, якою будемо користуватися як довідковим матеріалом. (Слайд 9)
Досить часто ми будемо стикатися з проблемою, як правильно записати формулу речовини, тобто скільки атомів того чи іншого елемента входить до складу цієї сполуки.
Зараз ми навчимося складати формули бінарних сполуки (які складаються з двох видів атомів), знаючи валентності елементів. Запишемо формулу: (Слайд 10)
NaO
Алгоритм складання формули бінарних сполук за валентністю:
- Над знаками хімічних елементів позначити їх валентність:
І ІІ
NaO
- Визначаємо найменше спільне кратне чисел, що виражають валентність:
![]()
І ІІ
NaO
- Ділимо найменше спільне кратне на валентність кожного елемента і знаходимо кількість атомів цього елемента, тобто індекс ( «1» не пишемо!)
2÷1= 2 (Na) 2÷2=1 (О)
Na2O
ІІІ. Закріплення знань учнів:
Робота в групах: (Слайд 11)
Розділити учнів на 4 групи. Можна розділити за бажанням, або як учні сидять, або, щоб змусити їх порухатися, за абеткою. Але не за прізвищами, а за іменами.
Кожна група отримує картку з двома завданнями. Працюють усі, дотримуючись правил співпраці, толерантності. Таким чином учні закріплюють вивчений матеріал.
|
Картка 1
PH3, SiH4, HCl, H2O
I II III V IV II II I KS, PO, AsO, SnS, NiCl
|
|
Картка 2
SiO2, Na2O, Fe2O3, SO3
IV II II I VII III CH, CaH, HgCl, MnO, AlF
|
|
Картка 3
Al2S3, CS2, FeS, Na2S, MgS
IV III IV II I NO, NH, SO, MgO, LiO |
|
Картка 4
FeCl3, NaCl, CaCl2, CaCl4
II II II IV II III II VII ZnS, CuS, HS, AlS, ClO |
IV. Рефлексія (Слайд 12)
Гра «Крокодил». Між групами влаштувати невелике змагання. Потрібно вийти двом учням групи до вчителя і за допомогою міміки та жестів показати сполуку, вказуючи валентність елементів. Перемагає та команда, котра швидше розгадає показане.
V. Домашнє завдання. (Слайд 13)
Опрацювати параграф в підручнику.
Виконати письмово в зошиті завдання: Визначте валентність елементів у таких сполуках:
а) HF, H2O, NH3, SiH4, HІ, NaH, CaH2;
б) N2O, NO, N2O3, N2O5, NO2, CuO, Cu2O


про публікацію авторської розробки
Додати розробку