Урок "Вода,її характеристики"
Вчитель: Рибченко Н. С. (Криворізька загальноосвітня школа І-ІІІ ступенів №116, вища кваліфікаційна категорія, старший вчитель)
Тема: Вода, її характеристики.
Мета: ознайомити учнів з хімічним складом води, особливостями будови молекули води та її властивостями в залежності від складу, з’ясувати причини здатності води розчиняти у собі інші речовини, вказати на значенні такої властивості у природі та житті людини; пояснити поняття водневого зв’язку; розглянути і порівняти області поширення води; встановити міжпредметні зв’язки з географією, біологією, математикою та причинно-наслідкові зв’язки між будовою, властивостями та застосуванням речовини; формувати навички самостійно здобувати знання, дотримання правил гігієни, БЖД та бережливого ставлення до природних водних ресурсів.
Обладнання: хімічна склянка з дистильованою водою, ложка, скляна паличка, кухонна сіль, електричне коло.
ХІД УРОКУ
І. Організаційний момент (2 хв.)
ІІ. Актуалізація опорних знань (6 хв.).
- Із переліку речовин вибрати бінарні
(на дошці ряд речовин або на екрані комп’ютера):
Na, NaCl, NaClO, Cl2O7, O2, Н2O.
- Визначити валентності елементів, які є у складі бінарних речовин.
- Вказати серед обраних оксиди.
- Які валентності Гідрогену та Оксигену у сполуках?
ІІІ. Вивчення нового матеріалу.
- Особливості складу та будови молекули (фронтальна робота з класом) (15 хв.)
- Яка формула води?
- Ця речовина проста чи складна? Бінарна чи ні?
- До якого класу речовин належить?
- Назвати елементи, що входять до складу речовини.
- Атомів якого елементу більше?
- Який елемент має більшу відносну атомну масу?
- Усно розрахуйте відносну молекулярну масу води.
- Розрахуйте масові частки Н і О у молекулі води.
Своїми відповідями на питання ви з’ясували склад молекули води. А як розташовані атоми Н та О у молекулі і які властивості води в залежності від цього? Розглянемо у підручнику (Попель П.П, Крикля Л.С.) на ст. 148 у параграфі 25 мал. 72. Атоми Н розташовані по відношенню до атома О під кутом 109,50, тому молекула – кутова. При цьому атоми набувають зарядів – Н позитивного та О негативного (з курсу фізики ви знаєте, що протилежно заряджені частинки притягуються), таким чином атоми утримуються у міцній молекулі. Між сусідніми молекулами теж виникає досить міцний зв'язок за рахунок протилежно заряджених сторін:
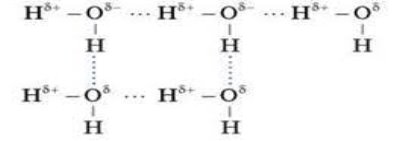
(Мал. вивести на екран комп’ютера) Такий зв'язок між молекулами називається водневий. Він надає воді такої особливої властивості, як розчиняти у собі інші речовини. Отже, речовини, що мають подібний водневий зв'язок, а також з іншими типами зав’язків, здатні розчинятися у воді. Як перевірити на досліді, у якій склянці вода чиста (дистильована), а у якій – водний розчин речовин (дослід з електричним колом)? Речовини молекулярної будови не є електролітами, тобто не проводять струм (лампа не горить). Якщо лампа горить, то речовини проводять струм. Проведемо експерименти і перевіримо електролітичні властивості води.
Дослід 1: Як бачимо, вода не проводить електричний струм (Лампа не горить у замкненому колі, тобто чиста вода – неелектроліт).
Дослід 2: Додаємо у цю воду трохи солі, розмішуємо до розчинення, під’єднаюмо розчин до електричного кола. (Лампа загорілася, отже у воді є розчинені речовини).
Дослід 3: Перевіримо воду з крану – чиста чи містить розчинені речовини (Лампа горить, отже вода містить розчинені речовини.).
(Учні роблять ВИСНОВОК: чиста вода не проводить електричний струм, струм проводять розчинені у ній речовини. Де у побуті чи яких життєвих ситуаціях треба застосувати ці знання? - При перебуванні надворі під час блискавки та грози або при користуванні несправними електроприладами.)
- Робота у групах (7 хв.):
І гр. «Географи». Поширеність води у природі (робота з географічною картою, що є на дошці або на екрані).
Порівняйте площі водної та земної поверхні нашої планети. Скільки % займає вода і суша?
Три агрегатні стани води за різних умов дають змогу поширюватися цій речовині і в усіх шарах атмосфери:
А) водяна пара – у повітрі у суміші з азотом, киснем, ін. домішками; а також клітини живих організмів;
Б) рідка вода – океани, моря, річки, озера, струмки тощо;
В) крига (твердий стан) – льодовики, айсберги тощо.
ІІ гр. «Фізики». Фізичні властивості води.
(самостійна робота з підручником за параграфом 25: скласти таблицю «Фізичні властивості води»: колір, смак, запах, густина, електропровідність, Ткип., Тпл.)
Знайдіть у параграфі відповідь на питання: чому вода у твердому стані має меншу густину ніж у рідкому?
ІІІ гр. «Хіміки». Хімічні властивості води (опрацювання тексту, наданого вчителем).
Загалом вода – досить стійка речовина, вона не розкладається за звичайних умов, але при температурі 10000 її все ж вдається розкласти на водень і кисень (з
10 000 молекул лише 3 розкладуться); при 30000 із 100 молекул розкладуться 11. Запишіть рівняння розкладу води (один з учнів на дошці записує рівняння розкладу води, ін. у зошитах).
Вона добре реагує з різними речовинами – активними металами, оксидами металів та неметалів.
Презентації роботи у групах (10 хв.).
ІV. Закріплення та узагальнення (3 хв.). Створити узагальнюючий опорний конспект-висновок «Характеристика води» за своїм авторським зразком малюнки, таблиця, схема, розгорнутий план тощо. Учитель вибірково перевіряє конспекти, оцінює).
V. Домашнє завдання (2 хв.).
1. Параграф 25;
2. Створити порівняльну таблицю «Вміст води у клітинах різних тканин організму людини» за інтернет-джерелами.


про публікацію авторської розробки
Додати розробку
