Усе про спирти для ЗНО та НМТ

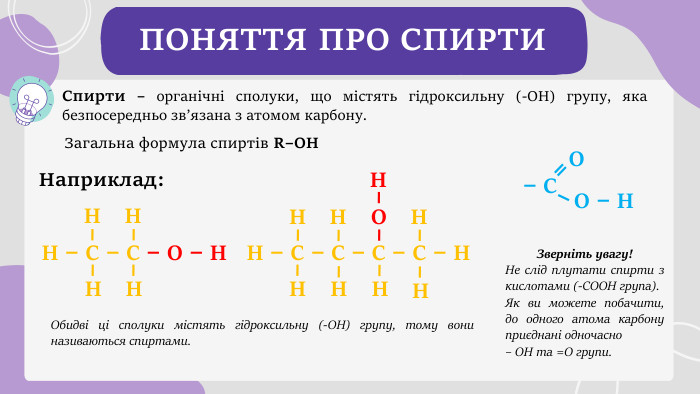
























Спирти – органічні сполуки, що містять гідроксильну (-ОН) групу, яка безпосередньо зв’язана з атомом карбону. ПОНЯТТЯ ПРО СПИРТИНаприклад: Обидві ці сполуки містять гідроксильну (-ОН) групу, тому вони називаються спиртами. Н – С – С – О – Н ННННН – С – С – С – С – НННННОН– С О – Н ОЗверніть увагу!Не слід плутати спирти з кислотами (-СООН група). Як ви можете побачити, до одного атома карбону приєднані одночасно – ОН та =О групи. НННЗагальна формула спиртів R–OH
Якщо молекула спирту містить одну гідроксильну (-ОН) групу, то він називається одноатомний, якщо дві – двохатомний, якщо три та більше –багатоатомний. Одноатомний спирт. КЛАСИФІКАЦІЯ СПИРТІВ ЗА КІЛЬКІСТЮ ГІДРОКСИЛЬНИХ ГРУПН – С – С – ОН ННННН – С – С – Н НОННОНН – С – С – С – Н НОНОННОННДвохатомний спирт. Багатоатомний спирт
КЛАСИФІКАЦІЯ СПИРТІВ ЗА БУДОВОЮ ВУГЛЕВОДНЕВОГО РАДИКАЛУЗа будовою вуглеводневого радикалу спирти бувають насичені, ненасичені та ароматичні. Н – С – С – С – Н НОНННННН – С = С – С – Н НОННН – СН2 – ОН Насичений спирт. Карбоновий ланцюг до якого приєднана –ОН група – насичений, тобто містить лише одинарні зв’язки Ненасичений спирт. Карбоновий ланцюг до якого приєднана –ОН група – ненасичений, тобто містить подвійні або потрійні зв’язки Ароматичний спирт. У складі карбонового ланцюга до якого приєднана –ОН група міститься бензольне кільце. Зверніть увагу! Гідроксильна група повинна бути приєднана до кільця через атом карбону. Якщо вона приєднана безпосередньо до кільця тоді така сполука називається фенол
КЛАСИФІКАЦІЯ СПИРТІВ ЗА ПОЛОЖЕННЯМ ГІДРОКСИЛЬНОЇ ГРУПИЯкщо гідроксильна група з’єднана з первинним атомом карбону – то такий спирт називається первинний. Якщо із вторинним та третинним, то відповідно спирт теж вторинний та третинний. Н – С – С – С – Н НОНННННН – С – С – С – Н НННОНННН – С – С – С – Н ННСН3 ОНННПервинний спирт. Гідроксильна група приєднана до первинного атома Карбону, тобто до атома, що з’єднаний лише з одним іншим атомом Карбону. Вторинний спирт. Гідроксильна група приєднана до вторинного атома Карбону, тобто до атома, що з’єднаний з двома іншими атомами Карбону. Третинний спирт. Гідроксильна група приєднана до третинного атома Карбону, тобто до атома, що з’єднаний з трьома іншими атомами Карбону
НОМЕНКЛАТУРА СПИРТІВНазва спирту складається з назви вуглеводневого радикалу + суфікс ОЛМолекула С2 Н5 ОН складається з вуглеводневого радикалу С2 Н5- та гідроксильної групи –ОН. Радикал С2 Н5 має назву етил, проте називаючи спирти доречно використати назву алкану, якому відповідає даний радикал – ЕТАН. Гідроксильна група означає суфікс ОЛ. З’єднавши ці дві частини отримаємо назву спирту етанол. ЕТАН + ОЛН – С – С – ОН НННН
У таких спиртах необхідно спочатку намалювати структурну формулу. Далі – правильно розставити нумерацію атомів Карбону. Називаючи спирти, карбоновий ланцюг яких має три або більше атомів карбону – необхідно вказувати номер атома до якого приєднана гідроксильна група. НН – С – С – С – С – Н НННОНННН1234 НОМЕНКЛАТУРА СПИРТІВДля цього визначаємо до якого крайнього атома Карбону спиртова (–ОН) група знаходиться ближче – той атом буде першим, далі розставляємо нумерацію по ланцюгу до атома Карбону іншого кінця. Після цього називаємо сприт: назва алкану + номер атома до якого прикріплена – ОН група + суфікс ОЛБУТАН-2-ОЛ
НОМЕНКЛАТУРА СПИРТІВНН – С – С – С – С – Н НОННОНОННН1234 Називаючи багатоатомні спирти необхідно перед суфіксом ОЛ вказувати префікс що позначає кількість –ОН груп у молекулі У назві таких спиртів обов’язково необхідно вказати всі атоми карбону на яких знаходиться функціональна група. Якщо два атоми знаходяться на одному й тому ж атому, вказуємо його номер двічі. Н – С – С – Н ННОНОН12 ЕТАН-1,1-ДІОЛБУТАН-2,2,4-ТРИОЛДі – 2 Три – 3 Тетра – 4 Пент – 5 Гекс – 6 Далі перед суфіксом ОЛ дописуємо префікс, що позначає загальну кількість –ОН груп, що міститься у спирті
ХІМІЧНА АКТИВНІСТЬ СПИРТІВХімічна активність спиртів залежить від: CH3 OH → C2 H5 OH → C3 H7 OH → C4 H9 OH → C5 H11 OH Зі збільшенням кількості атомів карбону в ланцюзі його хімічна активність знижуєтьсядовжини карбонового ланцюгарозгалуженості карбонового ланцюга. Н3 С – СН2 – СН2 – ОН Н3 С – СН – СН3 ОНН3 С – С – СН3 СН3 ОНАктивність спирту зменшується зі збільшенням розгалуженості їх ланцюгів. Тобто первинні спирти є найактивнішими, далі вторинні спирти і найслабшими є третинні спирти
ХІМІЧНІ ВЛАСТИВОСТІ ОДНОАТОМНИХ СПИРТІВ1. Взаємодія з активними металами: 2 СН3 – ОН + 2 Na = 2 CН3-ОNa + Н2↑ Атом Гідрогену в –ОН групі може заміщуватися активними металами (Na, K, Mg, Al )Натрій прореагував із метанолом, тому сполука має назву Натрій метанолят. Також цей атом може заміщуватися мінеральними кислотами, зокрема Нітратною (НNO3), така реакція називається нітрування2. Взаємодія з галогеноводнями: Гідроксильна –ОН група може повністю заміщуватися на галогени, при взаємодії з галогеноводнями (НCl, HF, HBr, HI) СН3 – О Н + Н Сl= CН3 Cl+ Н2 O Отримана сполука більше не містить спиртової групи, тому вона називається хлорметан
ХІМІЧНІ ВЛАСТИВОСТІ ОДНОАТОМНИХ СПИРТІВ3. Дегідрування спиртів: При дегідруванні первинних спиртів утворюються альдегіди. Н – С – С – О Н = ННННСН3– С Н О+ H2 ↑Н – С – С – О Н = ННННСН2= СН2 + H2 О4. Внутрішньомолекулярна дегідратація спиртів: При внутрішньомолекулярній дегідратації спиртів утворюються ненасичені вуглеводні та вода. Ця реакція називається внутрішньомолекулярною, тому що –ОН та Н відщеплюються від однієї молекули при цьому утворюється НОН тобто вода. Дана реакція відбувається за наявності каталізатора – концентрованої сульфатної кислоти. Таким чином із молекули спирту забрали воду, тобто дегідрували (гідр - вода)
ХІМІЧНІ ВЛАСТИВОСТІ ОДНОАТОМНИХ СПИРТІВ5. Міжмолекулярна дегідратація спиртів: Ця реакція називається міжмолекулярною дегідратацією оскільки в результаті утворюється вода, при цьому –ОН та –Н, для її утворення, відщеплюються від різних молекул. С2 Н5– ОН С2 Н5– О Н С2 Н5– О – С2 Н5 + H2 O Н2 SO4, to. У результаті реакції утворюється етер (тому вона ще називається реакція етерифікації).6. Естерифікація спиртів: H O– С2 Н5 = СН3– С OН О+СН3– С O – C2 H5 О+ H2 O Під час реакції взаємодіють спирт та карбонова кислота, в результаті чого утворюється естер та вода. Зверніть увагу, що –ОН група відокремлюється від кислоти, а –Н від спирту.
ХІМІЧНІ ВЛАСТИВОСТІ ОДНОАТОМНИХ СПИРТІВ7. Часткове окиснення спиртів спиртів:8. Повне окиснення спиртів спиртів (горіння): Повне окиснення спиртів, як й інших органічних сполук, відбувається з утворенням вуглекислого газу та води Спирти під дією сильних окисників (KMn. O4, K2 Cr2 O7) окиснюються до альдегідів. Якщо продовжити цю реакцію то альдегід окисниться до карбонової кислоти. ОН ОН3 С – СН2 – ОН СН3– С Н ОKMn. O4 СН3– С KMn. O42 С2 H5 ОН + 6 O2 = 4 CO2 + 6 H2 O
ОТРИМАННЯ ОДНОАТОМНИХ СПИРТІВ1. Гідроліз гідрогеналканів Подана реакція можлива лише за наявності каталізатора – лугу (KOH, Na. OH)С2 Н5– Cl + HOH KOHС2 Н5– OH + HCl 2. Гідратація алкенів. СН3 – СН = СН2 + H OH СН3 – СН – СН3 ОНЦя реакція відбувається за правилом Марковникова: при розриві подвійного зв’язку Гідроген приєднується до більш гідрогенізованого атома Карбону, а –ОН група – до менш гідрогенізованого.3. Відновлення альдегідів + H2 СН3 – CH2 – OH СН3– С Н ОNi, to. Відновлення альдегідів відбувається за наявності каталізатора – розжареної Платини або Нікелю
ОСОБЛИВОСТІ ОТРИМАННЯ ДЕЯКИХ ОДНОАТОМНИХ СПИРТІВМетанол та етанол мають свої специфічні реакції в результаті яких можна отримати ці спирти: МЕТАНОЛ можна отримати в результаті взаємодії монооксиду вуглецю та водню. СО + 2 H2 Cr2 O3 + Zn. OСН3 ОНСуміш СО + Н2 називається синтез газ. При його нагріванні за наявності каталізатора – суміш оксидів цинку та хрому утворюється метанол. ЕТАНОЛ як правило, отримують гідратацією етену. С6 Н12 О6 Спиртові дріжджіС2 Н5 ОНДана реакція лежить в основі отримання всіх алкогольних напоїв, та етилового спирту зокрема. СН2=СН2 + HOHН2 SO4 С2 Н5 ОНОбов’язковою умовою для проведення цієї реакції є наявність каталізатора – концентрованої сульфатної або ортофосфатної кислот. Ще один варіант отримання етанолу це бродіння глюкози
ПОШИРЕНІ СПИРТИ. МЕТАНОЛНайпростіший спирт – метанол. Він складається з одного атома карбону – вуглеводневий радикал метил та однієї функціональної гідроксильної групи (-ОН). CH3 OH Метанол широко використовується як розчинник. З нього виготовляють мурашиний альдегід (формальдегід, формалін). Метанол також відомий як «технічний спирт». Хімічні властивості метанолу такі ж як і в будь-яких спиртів, проте оскільки він містить лише один атом карбону – метанол є найактивнішим серед спиртів і дуже добре вступає в хімічні реакції. Зверніть увагу!Метанол є ДУЖЕ ТОКСИЧНОЮ речовиною. Вживання його у невеликих кількостях викликає сліпоту, а у більших (25-30 мл) – смерть. Органолептичною він не відрізняється від етанолу, таким чином на смак їх не можливо розрізнити. Метанол може міститися в алкогольних напоях поганої якості.
ПОШИРЕНІ СПИРТИ. ЕТАНОЛЕтанол – один з найпоширеніших спиртів. Він складається з двох атомів карбону – вуглеводневий радикал етил та однієї функціональної гідроксильної групи (-ОН). C2 H5 OH Етанол використовується як розчинник, дезінфектант (виявляє дуже сильні бактерицидні властивості), у хімічному синтезі; є основою алкогольних напоїв. Хімічні властивості етанолу не відрізняються від інших спиртів, він дуже добре вступає в хімічні реакції. Етанол може необмежено розчинятися у воді за рахунок утворення водневих зв’язків з молекулами Н2 О. Як і метанол є легкозаймистою речовиною. Фізіологічна дія етанолу. Порівняно з іншими спиртами етанол має меншу токсичність, проте виявляє дуже сильний психотропний ефект та згубну дію на всі органи та системи організму. Вживання невеликої кількості етанолу викликає стан сп’яніння, що характеризується порушенням мови, координації рухів та контролю за своїми діями. Крім того етанол ВИКЛИКАЄ ЗАЛЕЖНІСТЬ.
ХІМІЧНІ ВЛАСТИВОСТІ БАГАТОАТОМНИХ СПИРТІВХімічні властивості багатоатомних спиртів подібні до одноатомних. Вони реагують із: Лужними металами. Лугами. Мінеральними кислотами. Галогеноводнями. Наявність кількох гідроксильних груп підвищує кислотні властивості багатоатомних спиртів, завдяки чому вони легше вступають в реакції з лужними металами, можуть реагувати з лугами, а також із гідроксидами важких металів, зокрема Cu(OH)2 (про це далі)Для багатоатомних спиртів також характерні реакції естерифікації. Вони мають важливе біологічне значення, оскільки таким чином утворюються жири. Тобто жири є естерами гліцеролу та вищих карбонових кислот. (детально про це описано у відповідній темі - Жири)– О – С – С17 Н35 СН2 НС С – О – С – С17 Н35 – О – С – С17 Н35 Н2 ООО
Реакції багатоатомних спиртів, що супроводжуються розривом зв’язку О–Н, відбуваються ступінчасто. ХІМІЧНІ ВЛАСТИВОСТІ БАГАТОАТОМНИХ СПИРТІВ– ОНСН2 НС С – ОН– ОНН2 + НO-NO2 Н2 SO4– О – NO2 СН2 НС С – ОН– ОНН2 + Н2 OI стадія– О – NO2 СН2 НС С – ОН– ОНН2 + НO-NO2 Н2 SO4– О – NO2 СН2 НС С – О – NO2– ОНН2 + Н2 OIІ стадія– О – NO2 СН2 НС С – О – NO2– ОНН2 + НO-NO2 Н2 SO4– О – NO2 СН2 НС С – О – NO2– О – NO2 Н2 + Н2 OIV стадія. У подібних реакціях заміщення відбувається по стадіях, тобто спочатку заміщується один атом Гідрогену в –ОН групі, потім інший і так поки не замістяться усі. Зверніть увагу! Спочатку заміщуються крайні атоми (І, ІІ стадія), а потім ті що в середині.
ХІМІЧНІ ВЛАСТИВОСТІ БАГАТОАТОМНИХ СПИРТІВЯк уже писалося раніше, багатоатомні спирти можуть взаємодіяти із солями деяких важких металів, зокрема Купрум (ІІ) гідроксидом. Така реакція є якісною реакцією на багатоатомні спирти.– О НСН2 НС С – ОН– О НН2: НСН2 СН СН2 – О – ОН– ОН Сu ОН ОН СН2 СН СН2– О Н– ОН– ОН:– ОН СН2 НС С – О– ОН2 Сu Дві молекули гліцеролу з’єднуються з молекулою Купрум (ІІ) гідроксиду за поданою схемою. Таким чином утворюється два ковалентних зв’язки (зелені), інші два (червоні стрілки) це донорно-акцепторні зв’язки. Оскільки атоми Оксигену мають по одній спареній електронній парі, а йону Cu2+ не вистачає електронів Оксиген «ділиться» з ним і виступає донором, а Купрум приймає і стає акцептором. У результаті реакції блакитний Cu(OH)2 перетворюється на комплексну сполуку Купрум гліцерат яскраво-синього кольору.
ОТРИМАННЯ БАГАТОАТОМНИХ СПИРТІВ1. Окиснення алкенів у нейтральному або лужному середовищіСН3 – СН = СН2 + KMn. O4 + 2 HOH СН3 – СН – СН2 OН OН2. Гідроліз ди-, тригалогеноалканів Cl Cl. СН3 – СН – СН2 + KMn. O4 + 2 HOH СН3 – СН – СН2 OН OН+ 2 HCl 3. Гідроліз жирів. С17 Н35 – О – С – С17 Н35 СН2 НС С – О – С – С17 Н35 – О – С – С17 Н35 Н2 + 3 ОООHOH – ОН СН2 НС С – ОН – ОН Н2 + 3 – С OН О(Подана реакція є основною, що використовується для отримання гліцеролу)
ПОШИРЕНІ СПИРТИ. ГЛІЦЕРОЛГліцерол (гліцерин) – один з найпоширеніших багатоатомних спиртів. Він складається з трьох атомів Карбону – вуглеводневий радикал пропан та трьох функціональних гідроксильних груп (-ОН). Тому назва цього спирту за IUPAС ПРОПАН-1,2,3-ТРИОЛ. Гліцерол використовується для виробництва вибухових речовин (тринітрогліцеролу), синтетичних смол, антифризів. Також він широко поширений у косметичні промисловості, оскільки має здатність пом’якшувати шкіру. Оскільки гліцерол містить три функціональних групи він виявляє сильніші кислотні властивості, тому легше вступає в реакції пов’язані з розривом Н–О зв’язку, зокрема нітрування, естерифікація, взаємодія з галогеноводнями. – ОНСН2 НС С – ОН– ОНН2


про публікацію авторської розробки
Додати розробку


























