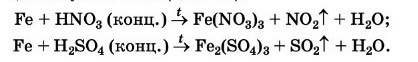Залізо: фізичні і хімічні властивості
Урок 47
11 клас Дата
Тема : Залізо: фізичні і хімічні властивості.
Цілі:
формування ключових компетентностей:
основні компетентності у природничих науках і технологіях;
соціальна та громадянська компетентності;
екологічна грамотність і здорове життя;
формування предметних компетентностей:
продовжити формувати вміння із застосування інформації про загальні властивості металів, застосовувати її при вивченні конкретного металічного елемента та його сполук; повторити положення Феруму в періодичній системі та особливості будови як елементу побічної групи; продовжити формувати уміння характеризувати фізичні і хімічні властивості речовин за допомогою хімічних реакцій;
формувати життєві , полікультурні та математичні компетентності .
Обладнання : мультимедійний проектор, періодична таблиця хімічних елементів Д.І. Менделєєва, ряд активності металів, підручник, зошит.
На кінець уроку учні:
називає загальні властивості металів;
пояснює положення металічного елента ферума у періодичній системі;
наводить приклади фізичних та хімічних властивостей феруму;
вміє складати рівняння хімічних реакцій.
Міжпредметні зв’язки: біологія, географія.
Тип уроку: вивчення нового матеріалу.
Хід уроку
І. Організаційний момент
ІІ. Актуалізація опорних знань
1.Фронтальна бесіда
- Де розташовані метали в періодичній системі?
- Яку будову мають атоми металічних елементів?
- Як змінюються металічні властивості по групах і періодах періодичної системи?
- Чому в хімічних реакціях метали лише відновники?
- Як металічний зв’язок і будова металічної кристалічної ґратки вплинули на фізичні властивості металів?
- Охарактеризуйте фізичні властивості металів.
- Який принцип покладений в основу електрохімічного ряду напруг?
- Що таке амфотерність..
ІІІ. Вивчення нового навчального матеріалу
Пошукова співбесіда (з елементами самоосвіти)
|
1. Характеристика Феруму за положенням у періодичній системі: - розташований у ІV періоді, VІІІ групі, побічній підгрупі. - Будова атома: порядковий номер 26, в атомі міститься 26 протонів, 26 електронів, 30 нейтронів. Електрони розподілені на 4 енергетичних рівнях Електронна формула атома — 1s22s22p63s23p63d64s2. - Ступені окиснення Феруму та тип хімічного зв’язку: проявляє ступінь окиснення +2, +3 електрони проявляє валентність |
|
|
2. Фізичні властивості заліза: — сріблясто-блискучий метал, має високу пластичність, легко намагнічується і розмагнічується. |
|
|
3.Поширення Феруму в природі: після Алюмінію — найпоширеніший. |
|
|
4. Найважливішими залізними рудами є Fe3O 4 — магнітний залізняк; FeS2 — пірит. Fe2 O 3 — червоний залізняк; Fe2O3*H 2 О — бурий залізняк; |
|
Хімічні властивості заліза
|
І. Пірофорність – здатність до самозаймання на повітрі в подрібненому вигляді. |
|
|
ІІ. Взаємодія з простими речовинами — неметалами - з галогенами при нагріванні( валентність максимальна) - з киснем ( окислюється або згоряє – утворює залізну окалину) - з сіркою |
Рівняння самостійно |
|
- На повітрі легко окислюється в присутності вологи:
|
|
|
ІІІ.. Взаємодія зі складними речовинами: 1. Взаємодія з кислотами — розчиняється:
- в хлоридній - розведеній сульфатній кислоті: |
|
|
2. Реагує з концентрованими кислотами :
Завдання ( по варіантах)до реакцій на стор 152 : Доберіть коефіцієнти методом електронного балансу
|
|
ІV. Закріплення знань
1. Допишіть схеми реакцій і складіть хімічні рівняння:
|
б) Fe +AgNO3= Fe(NO3)2+ Ag↓ Fe3O4+ H2= 3FeO + H2O Fe(OH)3+ 3PO4= ePO4+ 3H2O Fe(NO3)3+NaOH = Fe(OH)3↓+NaNO3 |
в) Fe + 2FeCl3= 3FeCl2 Fe2O3+ CaO = Ca(FeO2)2 Fe(OH)2↓= FeO + H2O FeS + 2HBr = FeBr2+ H2S↑ |
2. Яку масу ферум (ІІІ) нітрату потрібно взяти для добування 8 г ферум (ІІІ) оксиду?
|
Відомо:
m(Fe2O3)=8 г m(Fe(NO3)3)-?
|
Розв'язування Записуємо рівняння реакції: x г 8 г 4Fe(NO3)3=2Fe2O3 + 12NO2 + 3O2↑ 968 г 320 г M (Fe(NO3)3)=242 г/моль, а маса 4 моль тога =968 г M(Fe2O3)=160 г/моль, а маса 2 моль=320 г х=m(Fe(NO3)3)= 8 г • 968 г 320 г = 24,2 г Відповідь: 24,2 г |
V. Підбиття підсумків уроку
Рефлексія
VI. Домашнє завдання
- Опрацювати пар. 25; 2. С. 156 № 195 ( а ), 196; 3. Підготувати повідомлення про застосування сполуки феруму.
Оцінювання


про публікацію авторської розробки
Додати розробку