Жорсткість води та способи її усунення


















Дощова, річкова чи морська вода, підземні води завжди містять домішки, серед яких найпоширенішими є солі. Тому природна вода буває і жорсткою, і м'якою. Жорстка вода створює несприятливі умови для функціонування приладів, робота яких пов'язана з гарячою водою, погіршує прання, приготування їжі тощо. Жорсткість води
То для води, у якій перуть білизну, яку кип'ятять (під час приготування страв, чаю, кави тощо), використовують у системах опалення приміщень, їх наявність небажана і до певної міри шкідлива. Жорсткість води. Якщо у складі питної чи мінеральної води катіони Кальцію і Магнію є корисними у визначених межах споживання.
Жорсткість води. Жорсткість води — це природна властивість води, зумовлена наявністю в ній розчинних солей Кальцію і Магнію. Сумарну концентрацію йонів Магнію й Кальцію у воді називають загальною жорсткістю води. Вода, 1 л якої містить до 2 ммоль/л йонів Са2+ і Mg2+, вважається м'якою. Вода із вмістом йонів Са2+ і Mg2+ понад 10 ммоль/л вважається жорсткою. Прикладом м'якої води є дощова вода, жорсткої — вода морів і океанів.
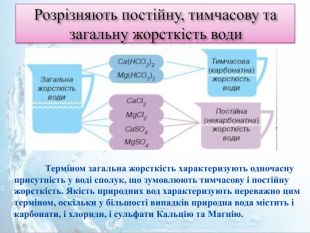
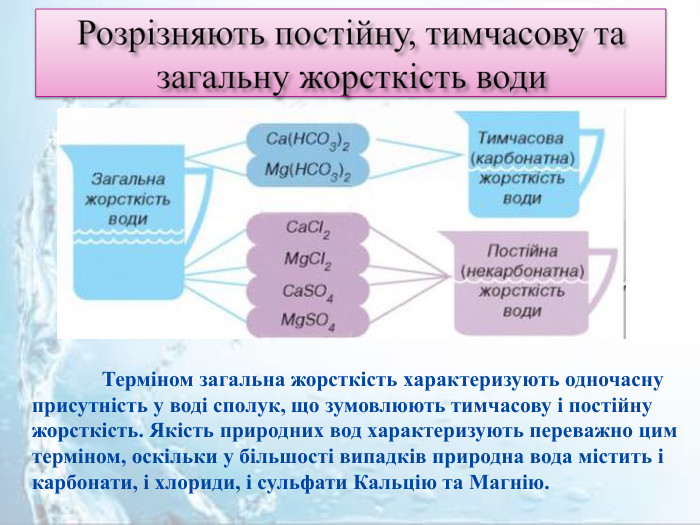
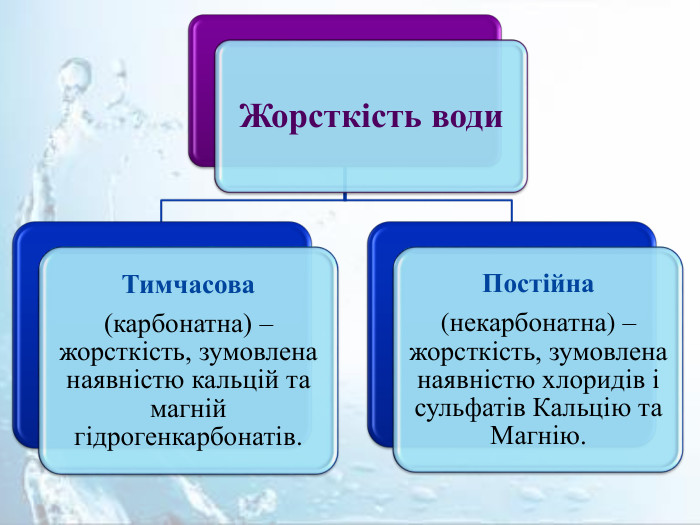
Розрізняють постійну, тимчасову та загальну жорсткість води Терміном загальна жорсткість характеризують одночасну присутність у воді сполук, що зумовлюють тимчасову і постійну жорсткість. Якість природних вод характеризують переважно цим терміном, оскільки у більшості випадків природна вода містить і карбонати, і хлориди, і сульфати Кальцію та Магнію.
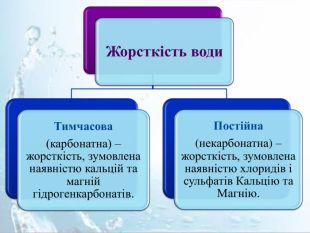
Тимчасова жорсткість Враховуючи здатність гідрогенкарбонатів розкладатися під час нагрівання з утворенням нерозчинного у воді кальцій карбонату, тимчасову жорсткість води можна усунути кип'ятінням: Са(НСО3)2 = Са. СО3↓ + Н2 О + СО2↑. Саме ця реакція відбувається під час кип'ятіння води, що має тимчасову жорсткість. Жорсткість води, зумовлена вмістом у ній кальцій гідрогенкарбонату та магній гідрогенкарбонату, дістала назву тимчасової, або карбонатної.
Тимчасова жорсткість Нерозчинні у воді карбонати, що утворюються з гідрогенкарбонатів, осідають на внутрішній поверхні посудин у вигляді білого осаду, утворюючи накип. Якщо вода містить солі Феруму, то накип набуває коричневого відтінку. Накип погіршує процес теплообміну в парових котлах і чайниках, призводить до перевитрат палива і перегрівання металевих поверхонь.
Постійна жорсткість Постійну (некарбонатну) жорсткість води усувають хімічним способом, використовуючи речовини, які переводять йони Кальцію і Магнію з розчину в нерозчинні сполуки. Це можуть бути натрій карбонат (кальцинована сода) Na2 CO3, натрій ортофосфат Na3 PO4 , аніони яких утворюють з катіонами Кальцію і Магнію нерозчинні сполуки, або воду пропускають через йонообмінні колонки. Mg. SO4+ Na2 CO3= Mg. CO3↓ + Na2 SO4;3 Ca. Cl2 + 2 Na3 PO4 = Са3(РО4)2↓ + 6 Na. Cl. Наявність у воді сульфатів і хлоридів Кальцію і Магнію зумовлюють постійну, або некарбонатну жорсткість води.
Способи усунення жорсткості води. Найпростіший спосіб усунення тимчасової (карбонатної) жорсткості води — її кип'ятіння. Ви неодноразово бачили, як на внутрішній поверхні чайників утворюється вапняний накип. Це і є ті нерозчинні у воді карбонати, що випадають в осад за кип'ятіння. Подібно до того як перетворюється кальцій гідрогенкарбонат, під час кип'ятіння води відбувається перетворення магній гідрогенкарбонату на магній карбонат. Рівняння реакції:
Способи усунення жорсткості води Тимчасову (карбонатну) жорсткість можна усунути, якщо подіяти вапняним молоком Са(ОН)2. Відбувається реакція: Ca(HCO3)2 + Са(ОН)2 = 2 Са. СО3↓+ 2 H2 O. Карбонати випадають в осад і під дією кальцинованої соди: Са(НСО3)2 + Na2 CO3 = Са. СО3↓ + 2 Na. HCO3. Вам відомо, що для прання використовують мило — натрієву сіль стеаринової кислоти. При додаванні мила до води відбувається реакція обміну катіонів Кальцію, що є у воді, на катіони Натрію, що містяться в милі. Унаслідок цього в осад випадає нерозчинний кальцій стеариноат, що призводить до надмірного використання мила під час прання. Рівняння реакції: Са(НСО3)2+2 C17 H35 COONa=(С17 Н35 СОО)2 Са↓+Na2 CO3+CO2↑+H2 O.
Способи усунення жорсткості води. Додаючи до води одночасно кальциновану соду й вапно, усувають і тимчасову (карбонатну), і постійну (некарбонатну) жорсткість. Воду зм'якшують не тільки в побутових умовах, а й на великих підприємствах. Один із способів — використання йонообмінних смол, які містять катіони Натрію чи Калію, здатні обмінюватися на катіони Кальцію та Магнію. Отже, суть процесу зм'якшення води полягає у виведенні з розчину катіонів Кальцію та Магнію, які спричиняють її жорсткість. Постійну (некарбонатну) жорсткість усувають дією кальцинованої соди. Рівняння реакцій: Ca. Cl2 + Na2 CO3 = Са. СО3↓ + 2 Na. Cl;Mg. Cl2 + Na2 CO3 = Mg. CO3↓ + 2 Na. Cl.
Способи усунення жорсткості води. Перспективним та ефективним способом усунення жорсткості води є йонітний. Для цього користуються йонообмінними колонками. Вони заповнені твердими нерозчинними у воді йонообмінними матеріалами із загальною назвою катіоніти, що містять рухливі йони, наприклад Натрію. Катіони Натрію обмінюються на катіони Кальцію і Магнію, що містяться у жорсткій воді. Унаслідок такого обміну катіони Кальцію та Магнію залишаються в йонообмінній колонці, а пом'якшена вода витікає з неї. Важливо також те, що йонообмінний матеріал піддається регенерації, тобто відновленню. Пом'якшення води в лабораторних умовах із використанням йонообмінної колонки
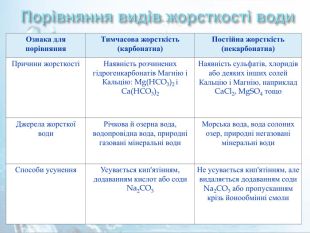
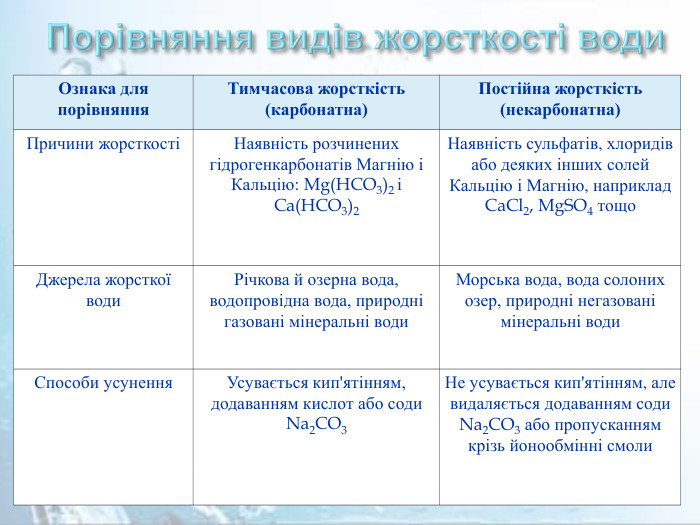
Порівняння видів жорсткості води. Ознака для порівняння. Тимчасова жорсткість (карбонатна)Постійна жорсткість (некарбонатна)Причини жорсткостіНаявність розчинених гідрогенкарбонатів Магнію і Кальцію: Mg(HCO3)2 і Ca(HCO3)2 Наявність сульфатів, хлоридів або деяких інших солей Кальцію і Магнію, наприклад Ca. Cl2, Mg. SO4 тощо. Джерела жорсткої води. Річкова й озерна вода, водопровідна вода, природні газовані мінеральні води. Морська вода, вода солоних озер, природні негазовані мінеральні води. Способи усунення. Усувається кип'ятінням, додаванням кислот або соди Na2 CO3 Не усувається кип'ятінням, але видаляється додаванням соди Na2 CO3 або пропусканням крізь йонообмінні смоли
Вплив жорсткої води на здоров'я людини Доведено, що висока концентрація йонів Кальцію та Магнію у воді впливає насамперед на шкіру та волосся. Мило не завжди повністю очищає воду, тому на шкірі залишаються рештки карбонатів. Вони забивають пори, погіршуючи дихання шкіри. Як наслідок, виникають подразнення, висипи, прищі, лупа. Від жорсткої води псується волосся: воно стає ламким, випадає, з'являється лупа. Тому після миття волосся важливо сполоскувати його кип'яченою водою.
Вплив жорсткої води на здоров'я людини Потрапляючи в надмірній кількості в організм людини, сполуки Кальцію та Магнію призводять до появи каміння в нирках і сечівниках, порушують роботу серцево-судинної системи, жовчних проток та опорно-рухового апарату, на стінках кишечнику осідають шлаки тощо. У домашніх умовах найефективнішим способом є використання фільтрів йонного обміну, які виробляє промисловість для побутового використання.
Вплив жорсткої води на здоров'я людини Використання жорсткої води спричиняє економічні затрати. На нагрівальних приладах осідає накип, що знижує електропровідність, а отже, зумовлює додаткове витрачання електроенергії. Унаслідок утворення накипу в парові котли та пральні машини можуть зламатися, з часом пристрої виходять з ладу.
ПІДСУМОВУЄМО ВИВЧЕНЕ• Жорсткість води зумовлена наявністю в ній катіонів Кальцію та Магнію.• Розрізняють тимчасову (карбонатну) і постійну (некарбонатну) жорсткість води.• Тимчасова жорсткість зумовлена наявністю у воді розчинних кальцій та магній гідрогенкарбонатів: Са(НСО3)2, Mg(HCO3)2. Її усувають кип'ятінням або хімічним способом за допомогою вапняного молока чи кальцинованої соди.• Постійна жорсткість зумовлена наявністю у воді інших солей Кальцію та Магнію, зокрема хлоридів і сульфатів. Її усувають дією кальцинованої соди:• Жорстка вода негативно впливає на здоров'я людини, викликаючи захворювання шкіри й волосся, нирок, серцево-судинної системи, жовчних проток, опорно-рухового апарату.• Використання жорсткої води призводить до економічних затрат.
-
 Волошина Олена Іванівна 09.01.2026 в 09:55Дякую!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Волошина Олена Іванівна 09.01.2026 в 09:55Дякую!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку