8кл. Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями. Лабораторний дослід №4-6.
8клас . Тема : Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями.
Лабораторний дослід №4-6. Взаємодія металів із солями у водному розчині. Взаємодія солей з лугами у водному розчині. Реакція обміну між солями в розчині.
Опрацювання матеріалу уроку надає можливість:
1. називає середні солі за сучасною науковою українською номенклатурою
2. вивчити хімічні властивості середніх солей
3 наводити приклади розчинних і нерозчинних основ,
4. складати рівняння можливих реакцій солей
5. відпрацювати навички користування таблицею розчинності
Ключові поняття і терміни: середні солі , реакція заміщення, обміну, якісна реакція.
Пригадайте :
- Які речовини називаються солями?
- З чого складаються солі?
- Як формується назва солі?
- Як класифікуються солі?
Вивчаємо новий матеріал
Перегляньте відео : https://www.youtube.com/watch?v=cq_pClYwtKQ&t=277s
Теоретичний блок : хімічні властивості солей
Переглянувши відео , з’ясували :
1. Солі реагують з металами : більш активні метали здатні витісняти менш активні метали з солей :

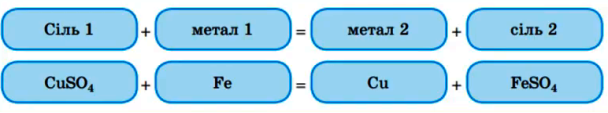
2. Сіль з кислотою : більш сильна кислота витісняє більш слабку кислоту.
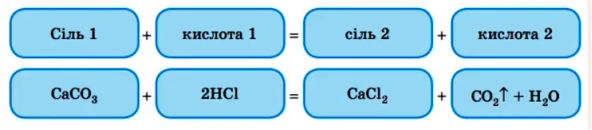
3. Сіль з лугом : обидва реагенти обов’язково розчини , а в результтаті реакції утворюється осад ( реакція обміну) – нерозчинна основа.
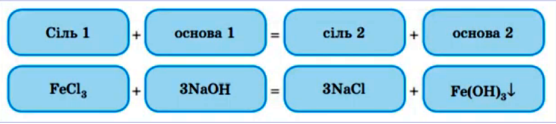
4. Сіль з сіллю : реагенти мають бути розчинами солей , а в ході реакції утворюється нерозчинна сіль .
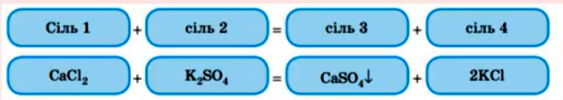
5. Розкладаються при нагріванні ( солі утворені оксигеновмісними кислотами) : СаСО3 = СаО + СО2
6. У водному розчині дисоціюють : з утворенням катіонів металу і аніону кислотного залишку : Al2(SO4)3 = 2Al3+ + 3SO42-
Перевіряємо себе ! Складаємо конспект :
«Хімічні властивості солей»
|
Приклад конспекту |
Відео лабораторних дослідів |
||
|
Пригадайте правила безпеки під час роботи з хімічними реактивами! |
|||
|
1. |
Лабораторний дослід №4 Взаємодія металів з солями у водних розчинах Мета : Дослідити особливості реакцій взаємодії розчинів солей з металами. Виявити ознаки реакцій та встановити їхні типи. Обладнання і реактиви : ________________ |
|
|
|
|
Zn + СuS04 = ? Сu + ZnS04 = ? Висновок : - Чи всі метали реагують із солями? - Користуючись рядом активностей металів, зробіть узагальнення, які метали реагуватимуть із розчинами солей Реакція заміщення – це___________________________________________ Ряд активності металів – це ______________________________________ |
||
|
2. |
Взаємодія солей з кислотами : А) Утворення нерозчинної солі : ВаCl2 +H2SO4= AgNO3 + HCl= Висновок : сіль (р) + кислота = нова сіль (н) + нова кислота
Б) Сіль слабкої кислоти з сильними кислотами : Na 2CO3+HCl= Висновок : сіль слабкої кислоти (р) + сильна кислота = = нова сіль (р) + вода + кислотний оксид (г) Увага ! Умови реакції обміну : - утворення осаду - виділення газу |
||
|
3. |
Лабораторний дослід №6 Реакція обміну між солями в розчині. Мета : Дослідити особливості реакцій взаємодії розчинів солей . Обладнання і реактиви ____________________ |
|
|
|
СаCl2 + Na2CO3 = СаCl2 + KNO3 = Висновок : Сіль (р) + сіль(р) = сіль (н) + сіль (р) - Що відбувається в пробірках? - Зробіть висновок що до взаємодії розчинів солей . Реакція обміну – це …..___________________ |
|||
|
4. |
Лабораторний дослід № 5 Взаємодія солей з лугами у водному розчині Мета : Дослідити особливості реакцій взаємодії солей з лугами в розчинах. Виявити ознаки реакцій та встановити їхні типи . Обладняння і реактиви :___________________ Хід роботи Спостереження : FeCl3+NaOH= Ва(OH)2+Na2SO4 = Na2SO4+ KOH = Висновок : Сіль (р) + луг = нова сіль (р) + нова основа (н) - Що відбувається в пробірках? - Зробіть висновок що до взаємодії розчинів солей з лугами. |
https://www.youtube.com/watch?v=QAk9Y67X52A
|
|
|
5
|
Термічний розклад солей: під час нагрівання деякі солі розкладаються
|
||
Узагальнення : Демонстрація №17. Хімічні властивості солей
https://www.youtube.com/watch?v=6eB4ewHvUJY
Тренувальні вправи :
Завдання №1 . Установіть відповідність між вихідними речовинами та продуктами реакції.
|
Вихідні речовини а) Сіль + оксид б) Луг + розчинна сіль → в) Термічний розклад нерозчинної солі г) Розчинна сіль +розчинна сіль → д) Метал + сіль е) Сіль слабкої кислоти + кислота |
Продукти реакції : 1.Сіль + основа 2.Не реагує 3.Основний оксид + кислотний оксид 4. Дві солі, одна з яких нерозчинна 5. Сіль + кислота 6. Метал + сіль |
Відповідь :
|
|
А |
Б |
В |
Г |
Д |
Е |
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
Завдання 2. Дописати рівняння можливих реакцій реакцій, назвати продукти реакції:
Mg(OH)2 + FeCl2 → NaOH + НBr →
BaCl2+ H2SO4 → Cu + ZnSO4 →
KOН + Cr(OH)3 → Mg + CuSO4 →
NaCl + AgNO3 → KCl + CaCO3 →
Завдання 3. Запишіть пропущені в рівняннях формули, розставте коефіцієнти:
а) K2CO3 + ...= K2SO4 + ...+ CO2 б) ...+ KOH = Fe(OH) 3 + ...
в) MgCO3 = MgO +... г) CrCl3+ ...= AgCl + ...
д) Zn + ...= ...+Fe
Завдання 4. Закінчіть рівняння реакцій:
а) залізо + купрум(ІІ) хлорид ______________________________
б) цинк сульфат + натрій гідроксид ___________________________
в) натрій карбонат + хлоридна кислота _________________________
г) кальцій хлорид + арґентум нітрат ______________________________
д) термічний розклад магній карбонату _______________________________
Завдання 5. Яка маса натрій карбонату реагує з хлоридною кислотою, якщо внаслідок реакції виділяється вуглекислий газ об’ємом 6, 72 л?
Домашнє завдання : - читати параграф №14 ,
- вивчити хімічні властивості солей.
Надіслати фото конспекту з виконаними завданнями.


про публікацію авторської розробки
Додати розробку




