Конспект уроку 8-го класу на тему: "Основи, їх склад, назви, класифікація"
Конспект уроку розроблений за новою програмою МОН
Автор: учитель хімії Панчівської загальноосвітньої школи І-ІІІ ступенів
Новомиргородської районної ради Кіровоградської області
Козак Юлія Олексіївна,
І кваліфікаційна категорія.
Урок №
Тема . Основи, їх склад, назви, класифікація.
Мета: на основі відомого матеріалу сформувати перше поняття про основи як
гідроксиди металів, пояснити їх склад та назви; дати уявлення про
графічне зображення їх формул; ознайомити із зразками
деяких основ (наприклад, гідроксидів натрію, кальцію,
міді (ІІ), заліза (ІІІ)), з класифікацією основ за розчинністю у воді;
виявити спільне у хімічному складі лугів і нерозчинних основ і дати
визначення основ; сформувати уміння складати формули основ,
використовуючи знання про валентність металів і гідроксогрупи,
класифікувати основи за їх розчинністю у воді; виховати повагу до
думки іншого, інтерес до предмета.
Базові поняття: гідроксильна група, луги, гашене вапно, вапняне молоко,
вапняна вода, нерозчинні основи, їдкі луги.
Засоби навчання: зразки основ – гідроксид натрію, гідроксид калію, гідроксид
купруму (ІІ), ферум (ІІІ) гідроксид, таблиця розчинності, презентація «Основи: класифікація».
Хід уроку
І. Організаційний момент. Вправа «Посмішка» Учні вітаються із сусідом праворуч, а потім - ліворуч. Побажанням вдалого уроку промовляючи з посмішкою.
ІІ. Перевірка домашнього завдання . Актуалізація опорних знань
-Завдання біля дошки(2 учні) http://LearningApps.org/display?v=p4ejn9prk16
-Завдання на карточках (2 учні)
|
Картка №1 1.Знайди відповідність: 1. Основні оксиди А. CaO Г. SnO 2. Амфотерні оксиди Б. SO2 Д. FeO 3. Кислотні оксиди В. ZnO Ж. CO2
|
|
Картка №2 1. Запишіть назву речовини, або якщо назва – формулу. 1) Магній оксид 5) Сульфур(IV)оксид 2) Натрій оксид 6) Ферум(ІІІ)оксид 3) CO2 7) Алюміній оксид 4) CaO 2. Задача. Визначте маси вищих оксидів фосфору, заліза, якщо кількість речовини кожного з них дорівнює 1, 5 моль. |
- Гра «Хрестики-нулики»
Виграшний шлях складають формули:
Варіант 1: основних оксидів. Варіант 2: кислотних оксидів.
|
ВаО |
P2O5 |
Na2O |
|
N2O |
Li2O |
SO3 |
|
SiO2 |
BeO |
Cs2O |
|
СаО |
CO2 |
СrO3 |
|
FeO |
N2O3 |
СО |
|
TeO3 |
P2O5 |
MgO |
ІІІ. Мотивація навчально-пізнавальної діяльності
Загадка:
Подвійну назву вони мають,
Розчинні у воді бувають.
На шкіру втраплять – смійся й плач
Відчуєш зразу вплив –ОН.
Не про молочні ріки й береги,
вели ми мову про (луги).
Підказка: з цими речовинами ви зустрічались при вивчені хімічних властивостей води, а саме при взаємодії води з активними металами і оксидами активних металів.
ІV. Пояснення нового матеріалу
1. Поняття основи та їх гідроксильна група.
Вам вже відомі речовини як гідрати оксидів активних металів. Пригадайте, де ви зустрічались з ними? (Вивчаючи хімічні властивості води.)
Гідроксильна група має валентність один. Від чого тоді ж залежатиме число гідроксильних груп? (Від валентності металу.)
Отже, основи – це складні речовини, в яких атоми металів сполучені з однією або кількома гідроксильними групами.
Загальна формула основ:
n I де Меt – позначення металу,
Меt(ОН)n n – його валентність.
Структурні формули основ:
NaOH Ca(OH)2 Al(OH)3
![]()
![]() O – H O – H
O – H O – H
![]() Na – O – H Ca Al O – H
Na – O – H Ca Al O – H
![]()
![]() O – H O – H
O – H O – H
Номенклатура. Назви основ складаються шляхом використання двох слів: перше – назва металу, друге “гідроксид”. Натрій гідроксидом (NaOH), кальцій гідроксидом Са(ОН)2. Якщо метал має змінну валентність, то її позначають римською цифрою в дужках після назви металу: СuОН – купрум (І) гідроксид, Сu (ОН)2 – купрум (ІІ) гідроксид.
Щоб скласти формулу основи за назвою, спочатку пишуть знак металу, потім – гідроксильну групу і складають формулу за валентністю:
ІІ І ІІІ І
Магній гідроксид - Мg(ОН)2 ; Ферум (ІІІ) гідроксид – Fе (ОН)3
Формула основи |
Систематична назва |
Традиційна назва |
NaOH |
Натрій гідроксид |
“їдкий натр”, “каусти-чна сода” |
|
KOH |
Калій гідроксид |
“Їдкий калій” |
|
Ca(OH)2 |
Гідроксид кальцію |
“гашене вапно” |
|
Ba(OH)2 |
Гідроксид барію |
“їдкий барит” |
Індивідуальне завдання. Написати формули речовин: літій гідроксиду, барій гідроксиду, стронцій гідроксиду, цезій гідроксиду, нікель (ІІ) гідроксиду, станум (ІІ) гідроксиду, хром (ІІІ) гідроксиду. ( самоперевірка)
Індивідуальне завдання. Написати назви основ відповідно до формули речовин: Zn(OH)2, Cu(OH)2 , NaOH, Ca(OH)2, Ba(OH)2, КОН . ( самоперевірка)
Демонстрація 6. Зразки основ
КОН, NaOH, Са(ОН)2, Сu(ОН)2 (свіжоприготовлений), Аl(ОН)3
• Що спільного у формулах основ, які є на вашому столі? (Наявність групи атомів -ОН — гідроксильної групи)
• Який клас неорганічних сполук називається основами?
• Від чого залежить кількість гідроксильних груп в основі? (Від валентності металу)
• Як можна в загальному вигляді записати формулу основ? (Me(ОН)m, де m — валентність металу)
Класифікація гідрооксидів
- в залежності від розчинності основ у воді
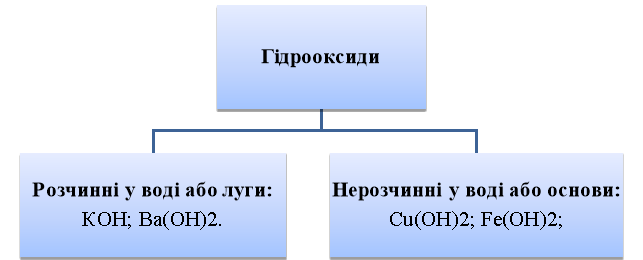
За нормальних умов усі луги — тверді речовини білого кольору, милкі на дотик, їдкі, роз’їдають шкіру, тканини, папір, не мають запаху.
Нерозчинні основи — тверді, здебільшого кристалічні, речовини різного кольору без запаху, не милкі на дотик.
Вправа «Ланцюгова реакція»
Завдання. Користуючись таблицею розчинності, наведіть формули і назви розчинних і нерозчинних гідрооксидів.
- в залежності від кількості гідроксильних груп у складі молекули основи
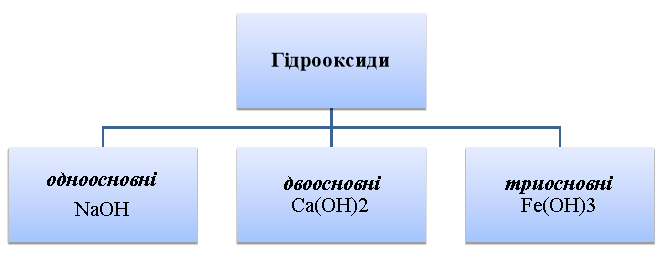
Вправа «Ланцюгова реакція»
Завдання. Користуючись таблицею розчинності, наведіть формули і назви одноосновних, двоосновних та трьохосновних гідрооксидів.
V. Узагальнення та систематизація знань
Завдання 1 http://LearningApps.org/display?v=ppwsbyv2t16
Складіть формули основ, утворених металами: Li, Mg, Fe(III), Ni(II), Cu(I), Al. Назвіть їх.
Завдання2. Отримайте двома способами натрій гідроксид і барій гідроксид.
Завдання 3 Гра «Сьомий зайвий»
Суть гри: вам пропонується сім речовин, з яких необхідно вибрати одну яка чимось не схожа на інших і пояснити чим саме.
KOH, Ca(OH)2, Ba(OH)2, CsOH, Zn(OH)2, NaOH, RbOH. (Всі інші сполуки є лугами).
Завдання 4. Гра «Хімічні гонки» http://LearningApps.org/display?v=pth954v0a16 Суть гри: потрібно скласти формули основ, яким відповідають такі оксиди: натрій оксид, магній оксид, цинк оксид, літій оксид; барій оксид, ферум (ІІІ) оксид, купрум (ІІ) оксид, літій оксид.
- самостійна робота
Варіант 1. Визначити, який об’єм водню (н. у.) виділиться, якщо водою подіяти на 4,6г натрію.
Варіант 2. Де більша масова частка Купруму: у гідроксиді купруму (І) чи у гідроксиді купруму (ІІ)?
Варіант 3. Яку масу оксиду алюмінію можна добути в результаті прожарювання гідроксиду алюмінію масою 312 г ?
VI. Підсумок уроку
- Яку тему ми розглядали на сьогоднішньому уроці?
- Що нового ви дізналися для себе із сьогоднішнього уроку?
- Назвіть основні моменти сьогоднішнього уроку, які варто пам’ятати завжди.
VII. Виставлення оцінок та їх мотивація
VIІI. Інструктаж з домашнього завдання
- Вивчити §
- Виконати завдання №
- Різнорівневі завдання:
А) Здійсніть перетворення:
1. Са ![]() СаО
СаО![]() Са(ОН)2
Са(ОН)2
2. Мg![]() MgO
MgO![]() Mg(OH)2
Mg(OH)2
![]()
MgCI2
Б) Де більша масова частка Феруму в гідроксиді феруму (ІІ) чи у
гідроксиді феруму (ІІІ)?
-
Супер!!!


про публікацію авторської розробки
Додати розробку
