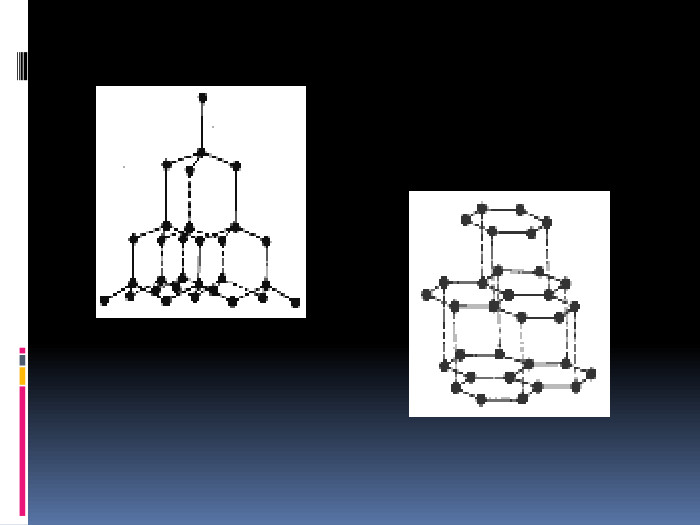
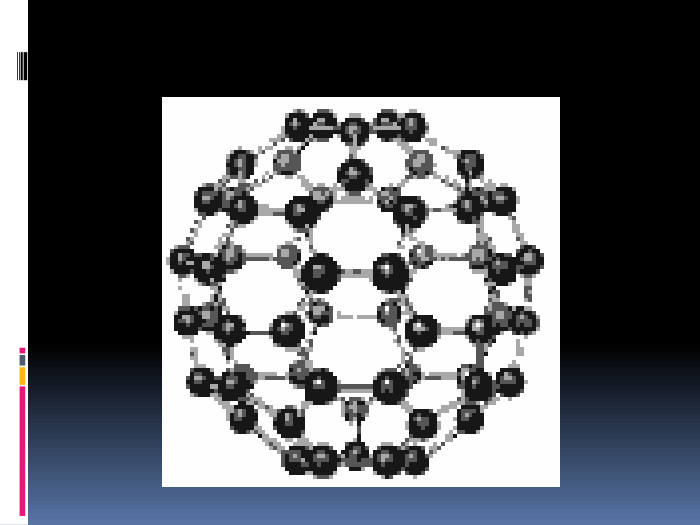
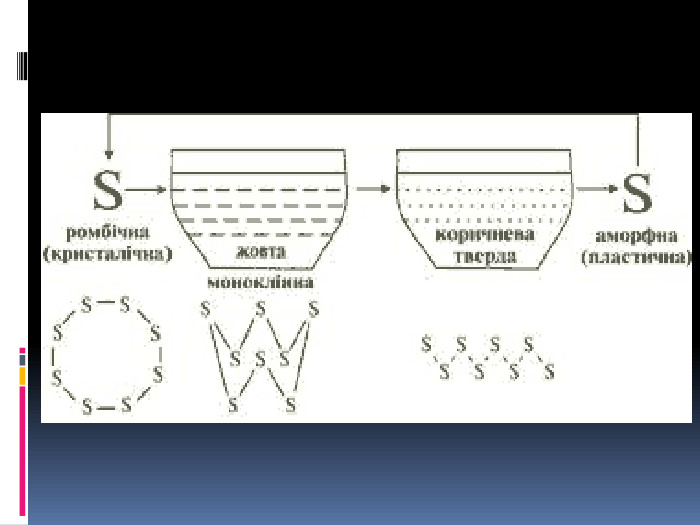
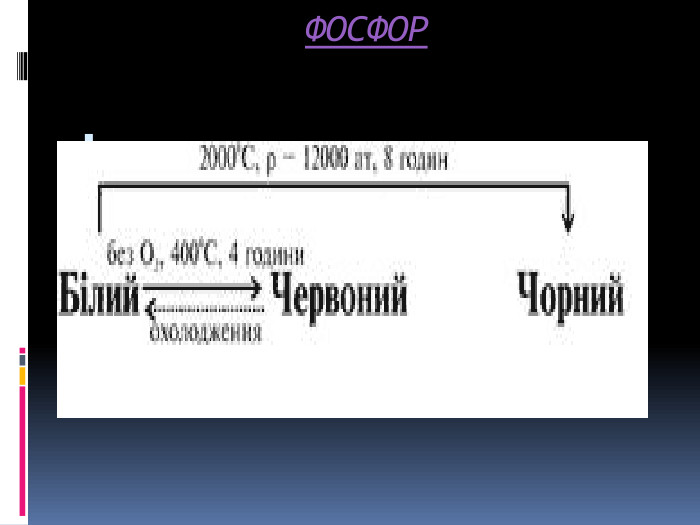
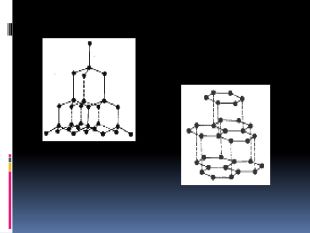
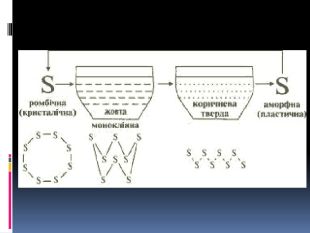
Алотропія. Алотропні модифікації деяких хімічних елементів
Про матеріал
Презентація містить теоретичний матеріал з даної теми, має наведені приклади речовин, нею може скористатися учитель під час пояснення матеріалу. Також може бути використаний учнями для підготовки до уроку. Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку