Алюміній і залізо: фізичні і хімічні властивості. Застосування металів та їхніх сплавів
Рівень стандарту. 11 клас. Тема 4. Неорганічні речовини і їхні властивості
Тема уроку: Алюміній і залізо: фізичні і хімічні властивості. Застосування металів та їхніх сплавів.
Мета уроку:
Освітня: сформувати в учнів знання про фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння студентів записувати рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму, розглянути біологічну роль заліза, його функції в організмі.
Розвиваюча: розвинути критичність, систематичність, послідовність мислення; встановлювати причино- наслідкові зв`язки; сформувати вміння порівнювати, аналізувати, робити висновки, працювати з додатковою науково-популярною літературою, готувати стислі повідомлення, розвивати вміння самостійно працювати з текстом та малюнками підручника.
Виховна: виховувати розуміння цінності природи як першоджерела матеріальних і духовних сил кожної людини; формувати науковий світогляд, здійснювати екологічне, естетичне, патріотичне виховання.
Тип уроку: комбінований
Методи і методичні прийоми: словесні (розповідь, пояснення, бесіда),наочні (демонстрація таблиць, гербаріїв), практичні (робота з таблицями, виконання лабораторної роботи, демонстрації).
Предметні компетентності:
учні складають рівняння реакцій, що підтверджують відновні властивості заліза, характеризують фізичні властивості та застосування заліза, порівнюють фізичні та хімічні властивості алюмінію і заліза, оцінюють біологічне значення Феруму.
Ключові компетентності:
спілкування державною мовою, математична компетентність, основні компетентності у природничих науках і технологіях, інформаційно-цифрова компетентність, екологічна грамотність і здорове життя, уміння вчитися упродовж усього життя.
Внутрішньопредметні і міжпредметні зв’язки: біологія, фізика, географія
Обладнання: реактиви періодична система хімічних елементів, таблиця розчинності, ряд активності металів, солі Феруму (ІІ), (ІІІ), червона кров’яна сіль, жовта кров’яна сіль , роданід амонію , штатив з пробірками , колекція сполук заліза, металева проволока.
Література:
- Навчальна програма для закладів загальної середньої освіти «Хімія 10-11 класи. Профільний рівень» URL:https://mon.gov.ua/ua/osvita/zagalna-serednya-osvita (дата звернення: 09.10.2022)
- Хімія ( рівень стандарту): підруч. для 11 кл. закладів загальної середньої освіти / П.П. Попель , Л.С. Крикля.-Київ : ВЦ «Академія», 2018.- 256 с.
Структура уроку:
|
№ етапу |
Етап уроку |
Час (хв.) |
|
1 |
Організаційний момент |
1 |
|
2 |
Перевірка домашнього завдання |
11 |
|
3 |
Мотивація навчальної діяльності, повідомлення теми, мети і завдань |
1 |
|
4 |
Сприйняття і усвідомлення учнями нового матеріалу, осмислення зв’язків та залежностей між елементами виучуваного |
20 |
|
5 |
Узагальнення і систематизація вивченого |
10 |
|
6 |
Підбиття підсумків уроку, аргументація оцінок |
1 |
|
7 |
Повідомлення домашнього завдання |
1 |
Хід уроку
І. Організаційний момент
Привітання. Перевірка присутності та готовності учнів до уроку.
ІІ. Актуалізація опорних знань
- Охарактеризуйте склад атома нукліда Алюмінію-27.
- Назвіть властивості алюмінію, завдяки яким цей метал використовують на практиці.
- Що таке періодична система хімічних елементів? (класифікація хімічних елементів, що встановлює залежність різних властивостей елементів від заряду їхнього атомного ядра).
- Які природні металічні елементи ви можете назвати? (золото, срібло, мідь, ртуть, платина).
- Скільки електронів містить атом Алюмінію, на скількох енергетичних рівнях вони розташовані? (містить 13 елетронів, на трьох енергетичних рівнях).
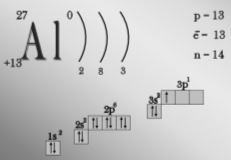
- Що таке амфотерність? (здатність сполук проявляти кислотні й основні властивості. Амфотерними є оксид Al2O3 і гідроксид Al(OH)3.)
- Що таке ртуть? (проста речовина, сріблясто-білий важкий метал, рідкий за кімнатної температури).
ІІІ. Мотивація навчальної діяльності, повідомлення теми, мети і завдань уроку
- З чим асоціюється у вас слово «метал» на прикладі алюмінію?
З чашкою, банкою з-під газованих напоїв, ложкою, виделкою... А може, з блискучим авіалайнером, який здіймається в небесну височінь? Про що б ми не подумали, дуже важко охопити уявою ту роль, яку відіграє алюміній у сучасному житті.
Отже, щоб зрозуміти це, давайте уявимо собі світ без алюмінію. У тому світі, без алюмінію, шлях із Європи до Америки займає довгі місяці, тому що доводиться плисти на важкому неповороткому кораблі. Дзеркала швидко мутніють і псуються. Високовольтні лінії електропередач роблять із важкої та дорогої міді. Немає альтернативи важким пляшкам зі скла та пластиковим пляшкам, які погано утилізуються. Як ми бачимо Алюміній відіграє важливу роль у нашому повсякденному житті, так як він найбільш поширений у природі. То ж давайте дізнаємось про метали якомога більше.
IV. Сприйняття і усвідомлення учнями нового матеріалу, осмислення зв’язків та залежностей між елементами виучуваного
В стародавні часи і в середні віки вважалося, що існує лише сім металів: золото,срібло,мідь,олово,свинець,залізо,ртуть. За уявою алхіміків метали зароджувалися в земних надрах під впливом променів планет і поступово украй повільно удосконалювалися, перетворюючись на срібло і золото. Алхіміки вважали, що метали — речовини складні, які складаються з «металічного начала» (ртуті) і «начала горючості» (сірки). На початку 18 століття набула поширення гіпотеза, за якою метали складаються із землі і «вогняної субстанції» — флогістону.
В кінці 18 століття А. Л. Лавуазьє спростував гіпотезу флогістону і показав, що метали — прості речовини. У 1789р. Лавуазьє у посібнику з хімії подав список простих речовин, в який включив всі відомі тоді 17 металів (Sb, Ag, As, Bi, Co, Cu, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn)
Метали складають понад 80% усіх хімічних елементів. Переважна більшість металів зустрічається в природі у вигляді різних сполук і лише деякі з них — у вільному стані. Це так звані самородні метали (золото і платина), а також інколи срібло, ртуть, мідь та інші метали.
Якщо в періодичній системі елементів Д. І. Менделєєва провести діагональ від берилію до астату, то праворуч угорі від діагоналі будуть елементи-неметали (виключаючи елементи побічних підгруп), а ліворуч унизу — елементи-метали (до них же належать елементи побічних підгруп). Елементи, розташовані поблизу діагоналі (наприклад, Be, Аl, Ті, Ge, Nb, Sb та ін.), мають двоїстий характер.

З 118 хімічних елементів, відкритих на даний момент (з них не все офіційно визнані), до металів відносять:
- 6 елементів в групі лужних металів (Li, Na, K, Rb, Cs, Fr),
- 4 в групі лужноземельних металів (Ca, Sr, Ba, Ra),
- 40 в групі перехідних металів,
- 6 в групі легких металів (Al, Ga, In, Sn, Tl, Ti),
- 7 в групі напівметалів (B, Si, Ge, As, Sb, Te, Po),
- 14 в групі лантаноїди + лантан,
- 14 в групі актиноїди (фізичні властивості вивчені не у всіх елементів) + актиній,
- поза певних груп берилій і магній.
Таким чином, до металів, можливо, відноситься 96 елементів з усіх відкритих.
Будова атомів металів: Метали мають великий атомний радіус і мале число електронів (від 1 до 3) на зовнішньому шарі.
Виключення:
Ge, Sn, Pb ─ 4 електрона;
Sb, Bi ─ 5 електронів;
Po ─ 6 електронів.
Атоми металів легко віддають електрони зовнішнього електронного шару, перетворюючись в позитивні іони (катіони).
Металічний зв’язок і кристалічна гратка Металічний зв’язок – це зв’язок між позитивними йонами та усуспільненими валентними електронами (електронний газ), які вільно рухаються.
Суть його полягає в тому, що атоми металічних елементів віддають свої електрони, які переміщуються по всій масі шматка металу, то приєднуючись до йонів, то відриваючись від них.
Кристалічні ґратки, у вузлах яких містяться позитивно заряджені йони і деяка кількість нейтральних атомів, між якими рухаються відносно вільні електрони, називаються металічними.
Кристалічна структура металів
Всі метали мають кристалічну будову. Розташовані тим або іншим способом атоми утворюють елементарну комірку просторової кристалічної решітки. Тип решітки залежить від хімічної природи.



А Б В
А. об'ємноцентрована кубічна (Fe, Cr, Mo, W)
Б. гексагональна щільноупакована (Mg, Co)
В. гранецентрована кубічна (Al, Ni)
Фізичні властивості металів зумовлені особливостями їх будови
- Агрегатний стан
- Колір
- Густина
- Твердість
- Пластичніть
- Ковкість
- Температура плавлення
- Електро- та теплопровідність
- Агрегатний стан: Усі метали, крім ртуті, за звичайних умов тверді речовини
- Колір : Більшість металів, за винятком золота та міді, мають сріблясто-білий або сріблясто-сірий колір. Усі метали мають характерний металевий блиск, який пояснюється наявністю в них вільних електронів.
Густина металів змінюються в широких межах
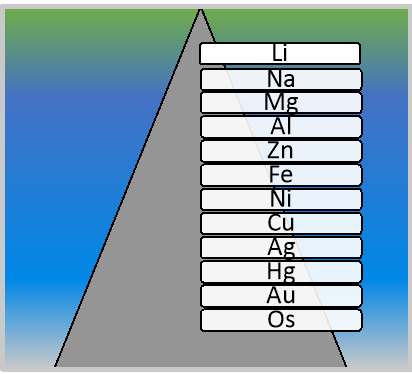
Осмій має густину в 42 рази більшу, ніж літій.
- Твердість. Найбільш твердим є хром, яким можна різати скло. Найбільш м’якими є натрій і калій, які легко ріжуться ножем. Також метали різняться своєю густиною. Найлегшим з металів є літій, а найважчим — осмій.
- Ковкість і пластичність. Оскільки йони в металічній гратці один з одним безпосередньо не зв’язані, то окремі їхні шари можуть вільно переміщатися один відносно одного під дією зовнішніх сил. Пластичність – це здатність легко змінювати форму під дією зовнішніх сил і зберігати одержану форму після припинення цієї дії. Найбільш пластичним є золото.
- Електрична провідність і теплопровідність. Метали – добрі провідники електрики і теплоти. Це зумовлено наявністю в металічних ґратках вільних електронів, які в електричному полі набувають спрямованого руху. Найбільшу електропровідність має срібло. Електропровідність і теплопровідність металів збільшується від Hg до Ag (Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag). Оскільки срібло дороге, в електротехніці використовують мідь і алюміній.
- Металічний блиск. У компактному стані метали мають характерний металічний блиск, тому що метали відбивають від своєї поверхні світлові промені, завдяки вільним електронам, а не пропускають їх як скло, і майже не вбирають, тому є непрозорими. Найкраще відбивають світло індій та срібло, тому їх використовують для виготовлення дзеркал.
- За температурами плавлення розрізняють легкоплавкі (tпл. до 1000°C) та тугоплавкі (tпл. понад 1000°C). Найбільш легкоплавкий метал ртуть (–38,9°C), цезій (+29°C) і галій (+29,8°C). Вольфрам – найбільш тугоплавкий метал (+3410°C). Він застосовується для виготовлення ниток розжарювання електроламп.
- Магнітні властивості – це здатність притягуватися магнітом. Магнітні властивості характерні для заліза, нікелю, кобальту.
Лабораторний дослід 3 – 8 «Виявлення у розчині катіонів Феруму(2+), Феруму(3+), Барію, амонію. Виявлення у розчинах силікат- і ортофосфат-іонів»
Мета: закріпити знання про хімічні властивості основних класів неорганічних сполук; навчитися виявляти в розчинах катіони Fe2+, Fe3+, катіонів Барію, катіонів амонію, силікат- іонів, ортофосфат – іонів; формувати вміння записувати результати спостережень, робити висновки
Обладнання: штатив із пробірками, піпетки
Реактиви: хлоридна кислота , кальцій карбонат, порошок заліза, розчин натрій або калій гідроксиду, кальцій гідроксиду, натрій хлориду, натрій ортофосфату, арґентум (І) нітрату, кальцій хлориду, натрій карбонату
Завдання: перегляньте відео проведення дослідів і оформіть звіт, давши відповіді на питання або заповнивши таблиці
Перегляньте відео за посиланням https://youtu.be/BiuvThAaO18
До даної роботи додається посилання на Padlet, де також розміщені інструкції до дослідів https://cutt.ly/1ys3qtX
Хід роботи
І. Лабораторний дослід № 3 « Виявлення в розчині катіонів Феруму2+ »
Перегляньте відео за посиланнями та запишіть спостереження і хімічні реакції до дослідів https://cutt.ly/Xyi4olf
|
Спостереження |
Рівняння хімічних реакцій у молекулярній та йонно- молекулярних формах |
Висновки |
|
_____________________ ______________________ _____________________ _____________________ _____________________ _____________________ _____________________
|
_________________________ _________________________ _________________________ _________________________ _________________________ _________________________ _________________________
|
За якою ознакою можна довести, що в пробірці містяться йони Fe2+? __________________________________________________________________________________________ |
Підбийте підсумки роботи
У процесі виконання лабораторного досліду ми навчилися
__________________________________________________________________
Зробіть загальний висновок
У розчині катіони Феруму2+ виявляють за допомогою_______________________________________________
_______________________________________________________________
Наявність катіонів Феруму2+ доводить ________________________________
__________________________________________________________________
Лабораторний дослід № 4 «Виявлення в розчині катіонів Феруму3+ »
Перегляньте відео за посиланнями та запишіть спостереження і хімічні реакції до дослідів https://cutt.ly/mysssgu
|
Спостереження |
Рівняння хімічних реакцій у молекулярній та йонно- молекулярних формах |
Висновки |
|
_____________________ ______________________ _____________________ _____________________ _____________________ _____________________ _____________________
|
_________________________ _________________________ _________________________ _________________________ _________________________ _________________________ _________________________
|
За якою ознакою можна довести, що в пробірці містяться йони Fe3+? ______________ __________________________________________________________________________________________ |
Підбийте підсумки роботи
У процесі виконання лабораторного досліду ми навчилися
__________________________________________________________________
Зробіть загальний висновок
У розчині катіони Феруму3+ виявляють за допомогою________________________________________________
_______________________________________________________________
Наявність катіонів Феруму3+ доводить ________________________________
Лабораторний дослід № 5 «Виявлення в розчині катіонів Барію»
Перегляньте відео за посиланнями та запишіть спостереження і хімічні реакції до дослідів https://cutt.ly/LyssQL0
|
Спостереження |
Рівняння хімічних реакцій у молекулярній та йонно- молекулярних формах |
Висновки |
|
Пробірка1____________________________________ ______________________ _____________________ Пробірка2______________ _____________________ _____________________ _____________________
|
Пробірка1__________________________________________ _________________________ _________________________ _________________________ Пробірка2__________________________________________ _________________________ _________________________
|
За якою ознакою можна довести, що в пробірках
містяться йони Ва2+? ___________________________________________________________________________ |
Підбийте підсумки роботи
У процесі виконання лабораторного досліду ми навчилися
__________________________________________________________________
Зробіть загальний висновок
У розчині катіони Барію виявляють за допомогою______________________________________________
_______________________________________________________________
Наявність катіонів Барію доводить
Лабораторний дослід № 6 Виявлення у розчині катіонів амонію.
Перегляньте відео за посиланнями та запишіть спостереження і хімічні реакції до дослідів https://cutt.ly/kyssGRa
|
Спостереження |
Рівняння хімічних реакцій у молекулярній та йонно- молекулярних формах |
Висновки |
|
____________________________________________ ______________________ _____________________ _____________________ _____________________ _____________________
|
__________________________________________________ _________________________ _________________________ _________________________ __________________________________________________ _________________________ _________________________
|
За якою ознакою можна довести, що в пробірці містяться
катіони амонію? ___________________________________________________________________________ |
Підбийте підсумки роботи
У процесі виконання лабораторного досліду ми навчилися
_________________________________________________________________
Зробіть загальний висновок
У розчині катіони амонію виявляють за допомогою ______________________________________________________________
Наявність катіонів амонію доводить ________________________________
Лабораторний дослід № 7 « Виявлення в розчині силікат-іонів»
Перегляньте відео за посиланнями та запишіть спостереження і хімічні реакції до дослідів https://cutt.ly/1yssC1Q
|
Спостереження |
Рівняння хімічних реакцій у молекулярній та йонно- молекулярних формах |
Висновки |
|
____________________________________________ ______________________ _____________________ _____________________ _____________________ _____________________
|
__________________________________________________ _________________________ _________________________ _________________________ __________________________________________________ _________________________ _________________________
|
За якою ознакою можна довести, що в пробірці містяться силікат-іони? ___________________________________________________________________________ |
Підбийте підсумки роботи
У процесі виконання лабораторного досліду ми навчилися
__________________________________________________________________
Зробіть загальний висновок
У розчині силікат-іони виявляють за допомогою ______________________________________________________________
Наявність силікат-іони доводить у________________________________
Лабораторний дослід № 7 «Виявлення в розчині ортофосфат-іонів»
Перегляньте відео за посиланнями та запишіть спостереження і хімічні реакції до дослідів https://cutt.ly/4ys9WNO
|
Спостереження |
Рівняння хімічних реакцій у молекулярній та йонно- молекулярних формах |
Висновки |
|
Пробірка1____________________________________ ______________________ _____________________ Пробірка2______________ _____________________ _____________________ _____________________
|
Пробірка1__________________________________________ _________________________ _________________________ _________________________ Пробірка2__________________________________________ _________________________ _________________________
|
За якою ознакою можна довести, в якій із пробірок містяться ортофосфатіони? ___________________________________________________________________________ |
Підбийте підсумки роботи
У процесі виконання лабораторного досліду ми навчилися
__________________________________________________________________
Зробіть загальний висновок
У розчині ортофосфат-іони виявляють за допомогою _________________________________________________________________________________________________________________________________
Наявність ортофосфат-іонів доводить у________________________________
V. Узагальнення і систематизація знань
КРОСВОРД «МЕТАЛИ»




 Розташуйте метали, що їх порядкові номери вказані у кружечках, у такому порядку, щоб у вертикальному стовпчикові можна було прочитати прізвище вченого, автора теорії електролітичної дисоціації.
Розташуйте метали, що їх порядкові номери вказані у кружечках, у такому порядку, щоб у вертикальному стовпчикові можна було прочитати прізвище вченого, автора теорії електролітичної дисоціації.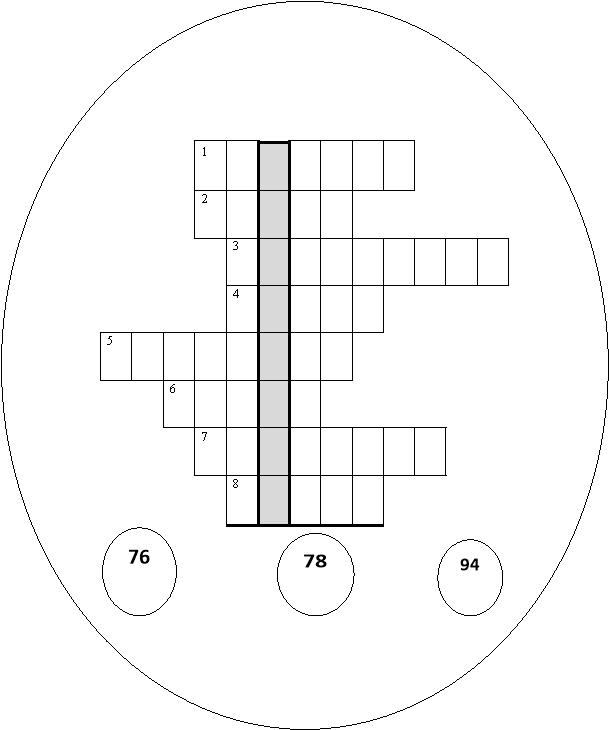
Підбиття підсумків уроку
VI. Інтерактивна гра « Мікрофон» закінчи речення.
« Сьогодні на уроці я повторив…»
« Сьогодні на уроці я зрозумів…»
« Сьогодні на уроці я дізнався…»
« Сьогодні на уроці я навчився…»
VII. Повідомлення домашнього завдання
Параграф 24, закінчити розв`язок завдань


про публікацію авторської розробки
Додати розробку
