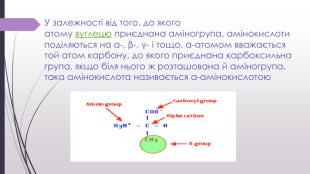
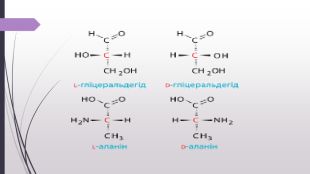
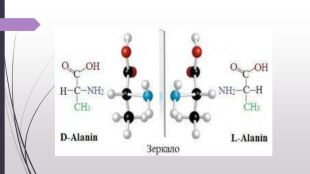
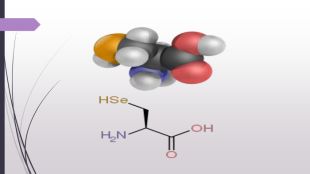
Амінокислоти їх будова та поширення .
Про матеріал
Презентація на тему : Амінокислоти .Висвітлені такі основні поняття, як амінокислоти, їх різновиди . Описано хімічну будову та ізомерія карбонового ланцюга, і оптична ізомерія. Опубліковано основні функції та поширення амінокислот .
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



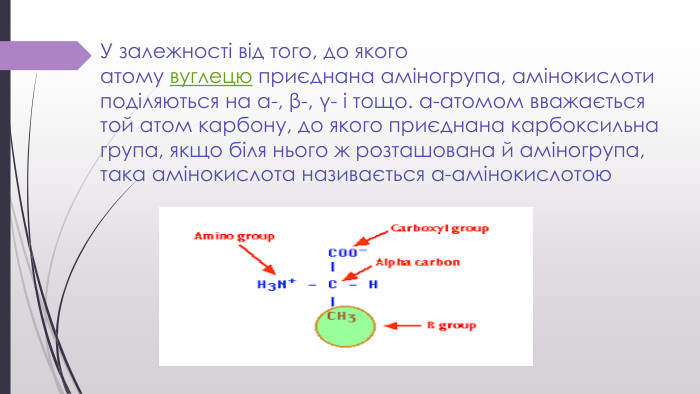






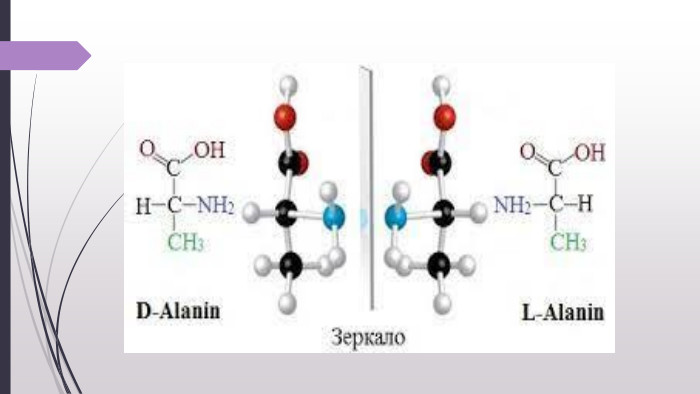

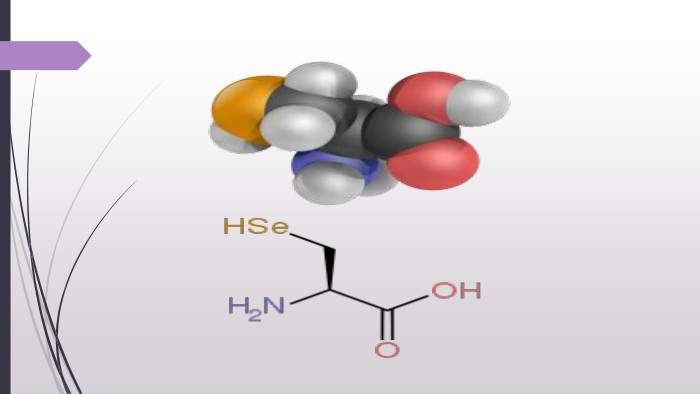
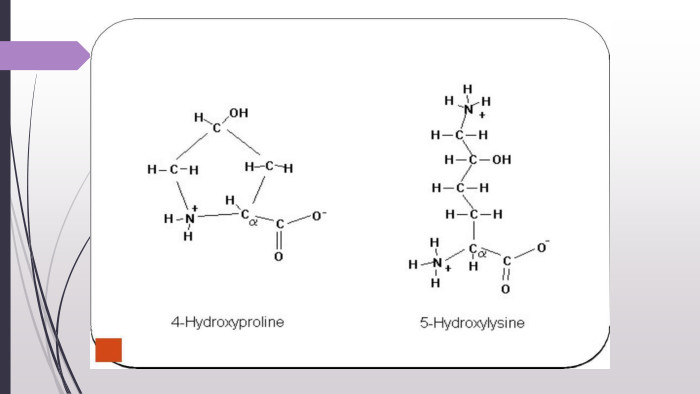
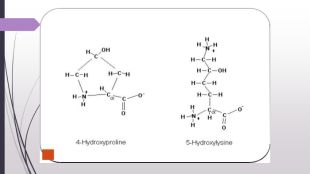
![«Нестандартні» амінокислоти. Крім 20 «стандартних» амінокислот, що кодуються генетичним кодом[1], у живих організмах також трапляється велика кількість так званих нестандартних амінокислот. У складі готових поліпептидних ланцюгів деякі залишки амінокислот можуть модифікуватись. Таким чином, наприклад, утворюються нестандартні амінокислоти 5-гідроксилізин і 4-гідроксипролін. Обидві входять до складу білка сполучної тканини колагену, а гідроксипролін знайдений також у клітинних стінках рослин. 6-N-метиллізин є складовою скоротливого білка міозину. Деякі білки, які зв'язують іони кальцію, наприклад, протромбін, містять γ-карбоксиглутамат. Десмозин — складна амінокислота, що утворюється із чотирьох залишків лізину — знайдена у фібрилярному білку еластині. Багато залишків амінокислот можуть бути посттрансляційно модифіковані тимчасово з метою регуляції функції білків. До таких модифікацій належить приєднання фосфатних, метильних, ацетильних, аденільних, АДФ-рибозильних та інших груп. «Нестандартні» амінокислоти. Крім 20 «стандартних» амінокислот, що кодуються генетичним кодом[1], у живих організмах також трапляється велика кількість так званих нестандартних амінокислот. У складі готових поліпептидних ланцюгів деякі залишки амінокислот можуть модифікуватись. Таким чином, наприклад, утворюються нестандартні амінокислоти 5-гідроксилізин і 4-гідроксипролін. Обидві входять до складу білка сполучної тканини колагену, а гідроксипролін знайдений також у клітинних стінках рослин. 6-N-метиллізин є складовою скоротливого білка міозину. Деякі білки, які зв'язують іони кальцію, наприклад, протромбін, містять γ-карбоксиглутамат. Десмозин — складна амінокислота, що утворюється із чотирьох залишків лізину — знайдена у фібрилярному білку еластині. Багато залишків амінокислот можуть бути посттрансляційно модифіковані тимчасово з метою регуляції функції білків. До таких модифікацій належить приєднання фосфатних, метильних, ацетильних, аденільних, АДФ-рибозильних та інших груп.](/uploads/files/4743340/388658/442501_images/13.jpg)