Арени. Бензен: молекулярна і структурна формули, фізичні та хімічні властивості.










Ароматичні вуглеводні навколо нас. В природі ліана виростає до 35 м, даючи плоди у вигляді тоненьких стручків з невеличкими бобами всередині. Батьківщина ванілі — Мексика та острови Карибського басейну. Ваніль (Vanilla planifolia) — витка ліаноподібна рослина роду ваніль родини орхідних , з якої люди використовують власне плід .
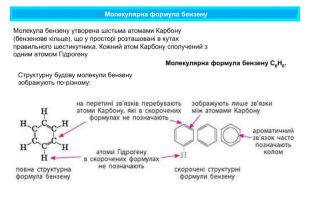
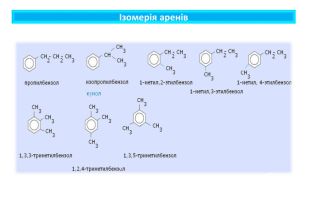
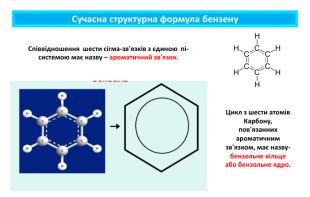
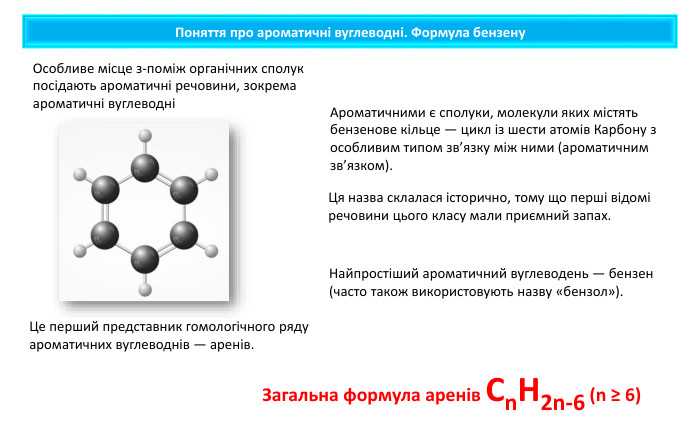
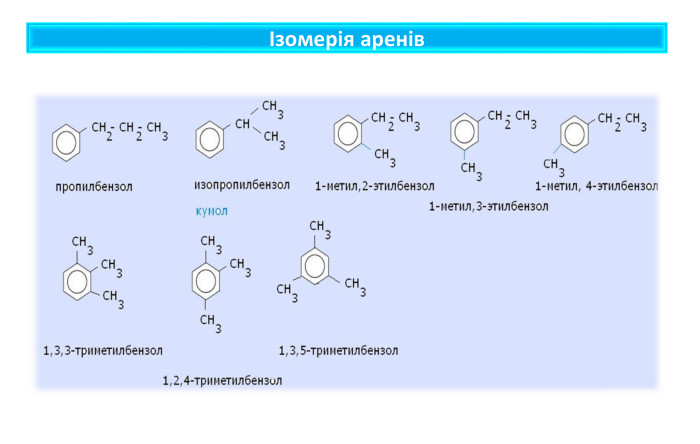
Поняття про ароматичні вуглеводні. Формула бензену. Ця назва склалася історично, тому що перші відомі речовини цього класу мали приємний запах. Особливе місце з-поміж органічних сполук посідають ароматичні речовини, зокрема ароматичні вуглеводніАроматичними є сполуки, молекули яких містять бензенове кільце — цикл із шести атомів Карбону з особливим типом зв’язку між ними (ароматичним зв’язком). Це перший представник гомологічного ряду ароматичних вуглеводнів — аренів. Найпростіший ароматичний вуглеводень — бензен (часто також використовують назву «бензол»). Загальна формула аренів Cn. H2n-6 (n ≥ 6)
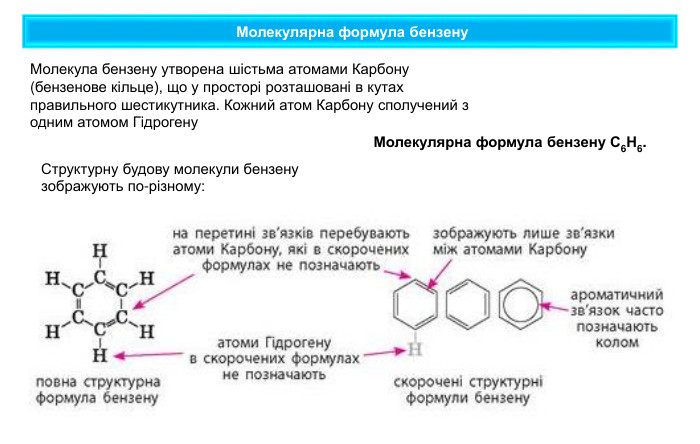
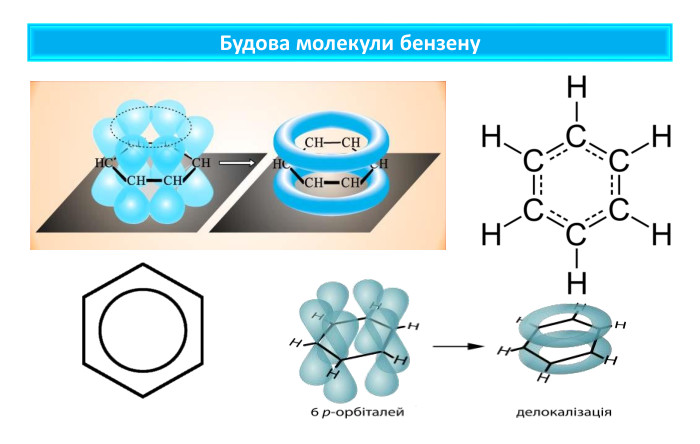
Молекулярна формула бензену Молекулярна формула бензену С6 Н6. Структурну будову молекули бензену зображують по-різному: Молекула бензену утворена шістьма атомами Карбону (бензенове кільце), що у просторі розташовані в кутах правильного шестикутника. Кожний атом Карбону сполучений з одним атомом Гідрогену
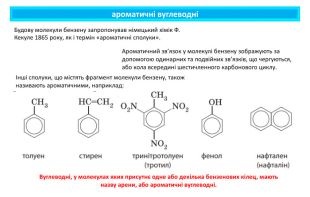
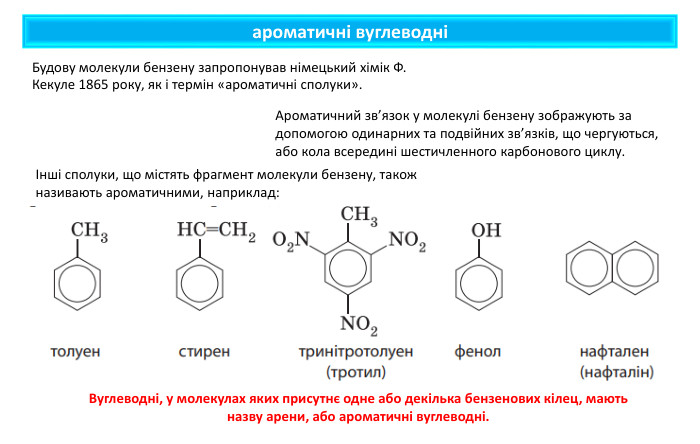
ароматичні вуглеводніБудову молекули бензену запропонував німецький хімік Ф. Кекуле 1865 року, як і термін «ароматичні сполуки».Інші сполуки, що містять фрагмент молекули бензену, також називають ароматичними, наприклад: Ароматичний зв’язок у молекулі бензену зображують за допомогою одинарних та подвійних зв’язків, що чергуються, або кола всередині шестичленного карбонового циклу. Вуглеводні, у молекулах яких присутнє одне або декілька бензенових кілец, мають назву арени, або ароматичні вуглеводні.
Фізичні властивості бензену• Безбарвна рідина зі специфічним «солодкуватим» запахом;tпл. = 5,5 °С, tкип. = 80,1 °С, ρ = 0,88 г/см3;не розчиняється у воді (0,08 г у 100 г води), добре розчиняється в органічних розчинниках і сам є добрим розчинником для багатьох органічних речовин;токсичний: вдихання випарів бензену спричиняє головний біль і запаморочення, за високих концентрацій бензену в повітрі можна знепритомніти. Випари бензену подразнюють очі й слизові оболонки;канцерогенний: підвищує ймовірність виникнення злоякісних пухлин, є ксенобіотиком — речовиною, чужорідною для живих організмів.
Хімічні властивості бензену1. Горіння. Як і всі вуглеводні, бензен добре горить. 2 С6 Н6 + 15 О2 → 12 СО2 + 6 Н2 ОУ надлишку кисню він згоряє безбарвним полум’ям з утворенням вуглекислого газу і води: Але в більшості випадків бензен горить кіптявим полум’ям 2 C6 H6 + 3 O2 → 12 C + 6 H2 O
Галогенування. Бензен взаємодіє з галогенами (Сl2 та Вr2) за наявності каталізаторів (галогенідів Алюмінію чи Феруму(ІІІ)). Унаслідок реакції заміщується один атом Гідрогену біля будь-якого атома Карбону: Хоча бензен не є насиченим вуглеводнем, але завдяки ароматичному зв’язку він є хімічно дуже малоактивною речовиною і тому для бензену характерні реакції заміщення, як для насичених вуглеводнів.
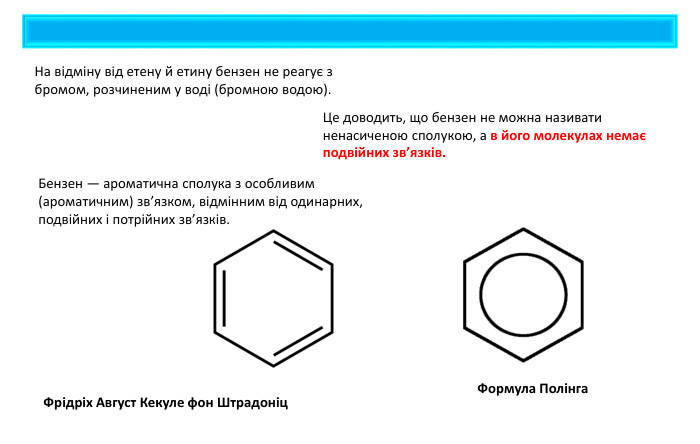
Бензен — ароматична сполука з особливим (ароматичним) зв’язком, відмінним від одинарних, подвійних і потрійних зв’язків. На відміну від етену й етину бензен не реагує з бромом, розчиненим у воді (бромною водою). Це доводить, що бензен не можна називати ненасиченою сполукою, а в його молекулах немає подвійних зв’язків. Фрідріх Август Кекуле фон Штрадоніц. Формула Полінга
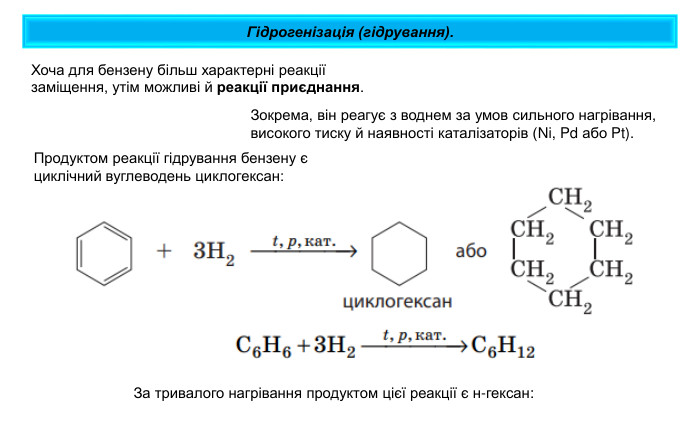
Гідрогенізація (гідрування). Хоча для бензену більш характерні реакції заміщення, утім можливі й реакції приєднання. Зокрема, він реагує з воднем за умов сильного нагрівання, високого тиску й наявності каталізаторів (Ni, Pd або Pt). Продуктом реакції гідрування бензену є циклічний вуглеводень циклогексан: За тривалого нагрівання продуктом цієї реакції є н-гексан:
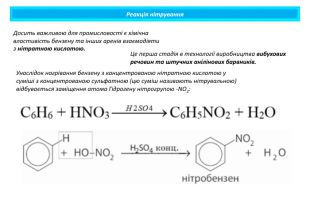
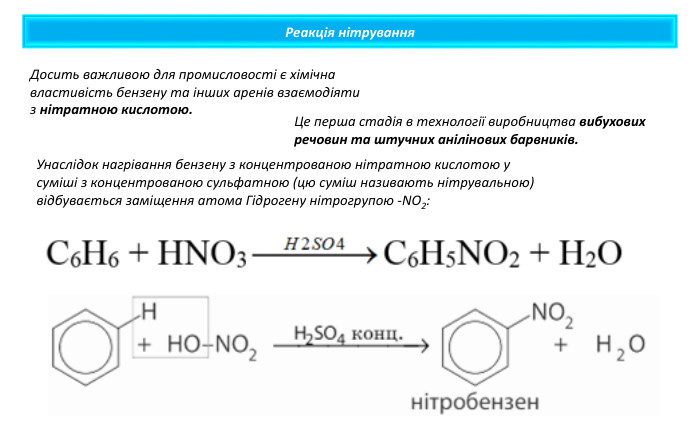
Реакція нітрування. Унаслідок нагрівання бензену з концентрованою нітратною кислотою у суміші з концентрованою сульфатною (цю суміш називають нітрувальною) відбувається заміщення атома Гідрогену нітрогрупою -NO2: Досить важливою для промисловості є хімічна властивість бензену та інших аренів взаємодіяти з нітратною кислотою. Це перша стадія в технології виробництва вибухових речовин та штучних анілінових барвників.
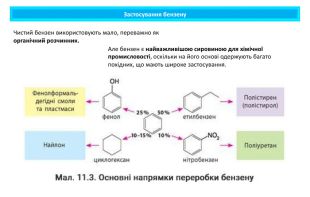
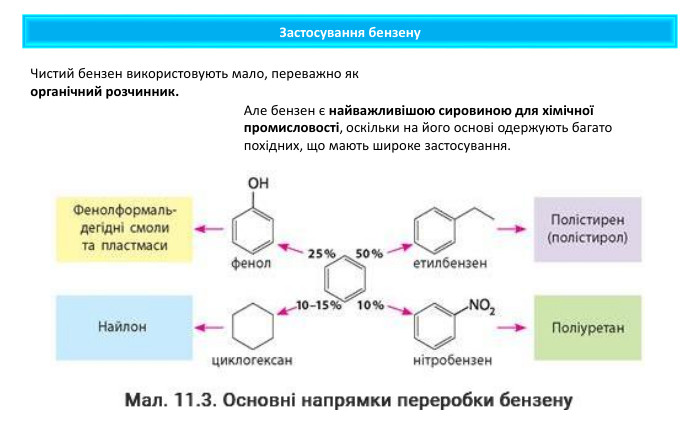
Бензен — сировина для виробництва ліків, барвників, полімерів, пестицидів, інсектицидів тощо Продукти нітрування бензену та його похідних використовують для виготовлення вибухівки. Продукти його взаємодії із сульфатною кислотою є основою для виготовлення синтетичних мийних засобів. Застосування бензену
Ароматичні вуглеводні навколо нас. У формі цукерки приваблює дітей, а також домашніх тварин, які можуть її проковтнути. Використовуються для обробки одягу. Нафталін, отриманий з похідних нафти, виділяє сильний запах, який відлякує різних шкідників. Токсичний, він канцерогенний і викликає проблеми з диханням.
ДДТ — класичний приклад інсектициду. За нормальних умов це біла кристалічна речовина без смаку і майже без запаху. Вперше синтезований в 1873 році австрійським хіміком Отмаром Цайдлером), він тривалий час не знаходив застосування, поки швейцарський хімік Пауль Мюллер (в 1939 році не відкрив його інсектицидні властивості. Дихлордифенілтрихлорметилмета́н— інсектицид, що використовується проти комарів, шкідників бавовника, соєвих бобів, арахісу. Поширена побутова назва ДДТ—«дуст». Дихлордифенілтрихлорметилмета́н—«дуст» Один з небагатьох дійсно ефективних засобів проти сарани. Заборонений для застосування в багатьох країнах через те, що здатний накопичуватися в організмі тварин і людини. Стійкий до розкладання в зовнішньому середовищі. Особливо згубно діє на розмноження птахів (накопичується в шкаралупі яєць). Незважаючи на це, обмежено застосовувався в СРСР і багатьох інших країнах.
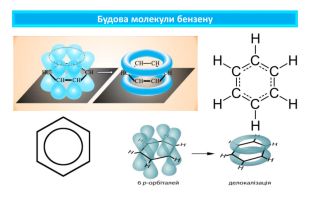
ПІДСУМОВУЄМО ВИВЧЕНЕБензен — найпростіший ароматичний вуглеводень, склад якого відображає молекулярна формула С6 Н6. У молекулі бензену зв'язки між атомами Карбону рівноцінні, їхня довжина становить 0,140 нм, тобто є однаковою. Валентний кут дорівнює 120°. Молекула має форму правильного шестикутника, плоска. Особливість будови молекули бензену зумовлює хімічні властивості сполуки. Зокрема, за певних умов він вступає в реакції приєднання (галогенів, водню) і заміщення. У промисловості бензен добувають переробкою кам'яного вугілля та з нафтопродуктів способом ароматизації. Застосовують як сировину в промисловості хімічного синтезу. Бензен шкідливо діє на організм людини, тому працювати з ним треба обережно, у лабораторіях — під витяжною шафою.


про публікацію авторської розробки
Додати розробку