Білки, їх будова, властивості, функції. Ферменти
Тема: Білки, їх будова, властивості, функції. Ферменти
Мета:
навчальна: вивчити склад, будову та структуру білків, властивості білків, їх функції, з’ясувати важливість білків для життєдіяльності організмів, властивості ферментів та їх механізм дії.
розвиваюча: розвивати пізнавальну активність, порівнювати, аналізувати та застосовувати здобуті знання.
виховна: виховувати повагу до іншої думки, формувати розуміння щодо згубної дії алкоголю, безпеки життєдіяльності.
виховна: виховувати повагу до іншої думки, вміння давати оцінку та самооцінку роботи.
Обладнання і матеріали: підручник, робочий зошит, роздатковий матеріал, ТЗН , таблиця “ Структура білків”, зразки білків (яйце, м'ясо, шерсть, шовк, горох, квасоля, пір’я, молоко, твердий сир; реактиви (СН3СООН, NaOH, HNO3), штатив з пробірками, спиртівки, пробіркотримач, сірники, дистильована вода.
Методи: проблемна бесіда, дискусія, демонстрації, робота в групах, відкритий мікрофон, розповідь, самостійна робота.
Форми роботи: індивідуальна, групова, фронтальна.
Тип заняття: засвоєння нових знань
Прийоми самостійної роботи студентів: прийом «Здивуй», спостереження, робота з підручником та дидактичним матеріалом.
Міжпредметні зв’язки: хімія, фізика, безпека життєдіяльності, валеологія, історія.
Нові поняття і терміни: «протеїни», «протеїди», «денатурація», «ренатурація», «деструкція», «поліпептиди».
Хід заняття:
І. Організаційний момент. План заняття. Емоційний настрій.
ІІ. Мотивація навчальної діяльності прийом «Здивуй».
Давайте спробуємо відгадати, що там знаходиться. А для цього використаємо супроводжувальні листи – підказки, які надійшли разом з скринькою.
Підказка 1. «Якщо організм висушити, після чого він стає неживим тілом, то виявляється, що більше, ніж половина його сухої маси припадає на цю речовину»
Підказка 2. «Тривалий час ця речовина здавалася ну просто уособленням життя й такою таємничною, що вчені до неї і підступитися боялися. Структура її стала по справжньому зрозумілою наприкінці 19 століття, зокрема завдяки дослідженням українського біохіміка І.Я. Горбачевського».
На столі викладені такі предмети : шовк, шерсть, яйце, м'ясо, горох чи
квасоля, пір’я.
Що об’єднує ці предмети, яка речовина входить до вмісту кожного з них. Так. Це білки. Вони і будуть темою сьогоднішнього заняття.
Отже, що є метою нашого заняття? Вивчити особливості будови білків, їх структуру, класифікацію, властивості, розширити і поглибити знання про функції білків в живих організмах, розглянути властивості ферментів та їх механізм дії.
В зошитах записати дату та тему заняття.
План заняття
1. Історія вивчення білків.
2. Елементарний склад і молекулярна маса білків.
3. Класифікація білків.
4. Структура білків.
5. Властивості білків.
6. Функції білків: заповнити таблицю, використавши роздатковий матеріал працюючи з підручником.
7. Поняття про ферменти.
ІІІ. Актуалізація опорних знань студентів:
Мозковий штурм
1. Які ви знаєте класи органічних сполук?
2. Які ви знаєте основні класи вуглеводів? Які їхні властивості?
3. Які основні функції виконують вуглеводи в організмах різних істот?
4. Що таке ліпіди?
5. Які основні групи ліпідів вам відомі?
6. Які функції ліпідів у живих організмах?
IV. Вивчення нового матеріалу:
“Життя є спосіб існування білкових тіл, істотним моментом якого є постійний обмін речовин з тією, що оточує їх зовнішньою природою, причому з припиненням цього обміну речовин припиняється і саме життя, що наводить до розкладання білка”. (Ф.Енгельс)
Білкові речовини були відомі людині з давніх - давен. Лише на початку XIII ст. було встановлено, що речовини, які містяться в соках рослин, екстрактах тваринних тканин, мають однакову природу. Вперше почав вивчати хімію білкових речовин Я. Бекаррі. У 1728 р. він виділив із пшеничного борошна білок — клейковину і дослідив деякі його властивості.
У той же час білки вивчав і француз А.Фуркруа. Він грунтовно дослідив білки сироватки крові і назвав її три компоненти — желатин, альбумін, фібрин.
Вміст білків в організмі людини: у м'язах — 80%, в шкірі — 63%, впечінці — 57%, в кістках — 28% .
Білки - обов'язкова складова частина усіх живих клітин, відіграють виключно важливу роль в живій природі, є головним, найбільш цінним і незамінним компонентом харчування. Білки є основою структурних елементів і тканин, підтримують обмін речовин і енергії, беруть участь в процесах зростання і розмноження, забезпечують механізми рухів, розвиток імунних реакцій, потрібні для функціонування усіх органів і систем організму.
Білки – це високомолекулярні біополімери мономерами яких є амінокислоти.
1. Історія вивчення білків
1) Розпочалося дослідження білків ще 1728 року італійцем Л. Беккарі, який виділив із пшеничного борошна клейку масу (клейковину) та дослідив її властивості, що виявилися близькими до властивостей речовин тваринного походження.
2) Лише через 100 років ученим удалося систематизувати властивості білків, зрозуміти, що вони є головним компонентом живої природи.
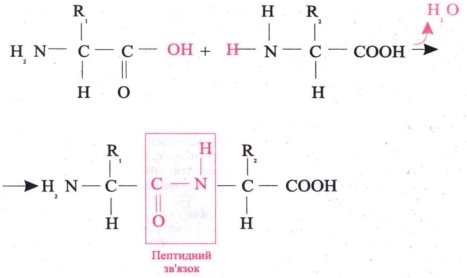
3) На початку 80-х років XIX ст. російський учений О. Я. Данилевський вказав на наявність пептидних груп у молекулі білка.
4) Назва «білок» походить від німецького слова “eiweis”, що означає «білок яйця». У 1839 р. датський вчений Мульдер, беручи до уваги важливе значення білків, запропонував для них назву «протеїн» (перший, найважливіший), у науці залишилися обидві ці назви – білки та протеїни.
5) На початку ХХ ст. німецький хімік Еміль Фішер висловив поліпептидну теорію будови білків, заклав основи їх хімічного синтезу, сам синтезував поліпептиди, що містили 18 амінокислотних залишків (1907 р.) (1902 р. — лауреат Нобелівської премії).
5) 1932 р. американський біохімік Вінсент Дю Віньо синтезував перший поліпептидний гормон окситоцин, а пізніше встановив структуру вазопресину. 1995 р. він отримав Нобелівську премію.
6) З 1944 по 1955 р. тривали дослідження Фредеріка Сенгера, який також став Нобелівським лауреатом за розшифрування структури гор мону інсуліну (1958 р.).
7) Зараз триває робота вчених з розшифрування структури й синтезу білків.
2. Елементарний склад і молекулярна маса білків.
За елементарним складом білки відрізняються від жирів і вуглеводів тим, що, крім вуглецю, водню і кисню, їх молекули містять азот. Крім того, всі рослинні і більшість тваринних білків мають у своєму складі сірку (0,3 – 2,5%). Деякі фізіологічно важливі білки містять фосфор (0,5-0,6%).
Білки – вислкомолекулярні сполуки. Найбільш точно можна обчислити молекулярні масу білків за швидкістю дифузії їх з розчину в чистий розчинник через пористу скляну перетинку і за швидкістю осідання в ультрацентрифугах, що дають до 80 000 обертів в хвилину. Визначена різними методами молекулярна маса коливається від кількох тисяч до 10 і більше міліонів (віруси сказу, віспи). Молекулярна маса гормону інсуліну близько 6500, а білка вірусу грипу – 32 млн. Молекулярна маса одного з білків яйця дорівнює 36000 дальтон. Молекулярна формула гемоглобіну крові: (С738Н1166О208S2Fe)4.
Число амінокислотних залишків, що входять в молекули окремих білків, дуже різне: У інсуліні – 51, в міоглобіні – близько 140.
Білки – це високомолекулярні біополімери мономерами яких є амінокислоти, що з’єднані пептидними зв’язками. .
Показати утворення пептидного зв’язку на дошці
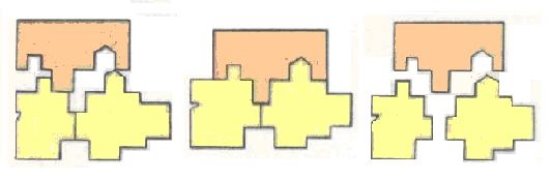
Класифікація білків.
Всього в природі відомо близько 200 амінокислот, які розрізняються радикалами і взаємним розташуванням функціональних груп, але тільки 20 з них можуть входити до складу білків. Такі амінокислоти називають протеїногенними.
Існує багато різних класифікацій амінокислот. Їх класифікують на замінні та незамінні.
Замінні амінокислоти можуть синтезуватись в організмі людини і тварин з продуктів обміну речовин.
Незамінні амінокислоти в організмі людини і тварин не синтезуються. Вони надходять до організму разом з їжею. Їх синтезують рослини, гриби, бактерії.
Завдання студентів
Зпаповніть таблицю «Класифікація білків» в опорному крнспекті
![]()
![]()
![]()






![]()
![]()
![]()
![]()




4. Структурні рівні організації білків.
Метод вивчення: випереджувальне навчання.
Чотирьом групам студентів було домашнє завдання розробити молекулу білків та повторити про хімічні зв’язки.
Відомо чотири рівні просторової організації, або конформації білків: первинний, вторинний, третинний і четвертинний.
|
Структура молекули білка |
Загальний вид структури |
Тип зв'язку |
|
первинна |
Певна послідовність амінокислотних залишків, з’єднаних за допомогою пептидних звязків (ланцюг) |
пептидний |
|
вторинна |
це з`єднання, закручене в спіраль, або поліпептидний ланцюжок (спіраль) |
водневий |
|
третинна |
Здатність поліпептидної спіралі закручуватися у клубок-глобулу, забезпечує функціональну активність білків (глобула) |
Гідрофобні, гідрофільні, водневі, дисульфідні зв’язки, іонні |
|
четвертинна |
формується кількома глобулами білка. Так гемоглобін – це комплекс чотирьох глобул |
Гідрофобні, водневі, пептидні, ковалентні електростатичні |
5. Властивості білків.
Метод вивчення: пояснювально-демонстративний, проблемний, робота з опорним конспектом, робота з підручником, бесіда.
Фізичні властивості білків.
Будовою білків пояснюються їх дуже різноманітні властивості.
Природні білкові речовини дуже різноманітні: є рідкі, напіврідкі, тверді білки. Деякі білки мають консистенцію в’язких рідин або студнів. Більшість білків – аморфні порошки. Деякі з них майже нерозчинні (наприклад, білок колаген), а деякі розчиняються, але залежно від властивостей у різних розчинниках. При розчиненні білків у воді утворюється своєрідна молекулярно-дисперсна система (розчин високомолекулярної речовини). Деякі білки можуть бути виділені у вигляді кристалів (білок курячого яйця, гемоглобіну крові).
Бесіда
• Чи мають білки певні температури кипіння?
(Ні, бо під час нагрівання вони темніють і розкладаються, поширюючи запах паленого пір'я. )
• Чому, купуючи вовняну річ, нитку з неї пропонують підпалити?
Демонстраційний дослід виконує викладач
Дослід 1. Денатурація білка
Нагрійте розчин білка у полум’ї спиртівки. Що спостерігається? Охолодіть та додайте води. Чи спостерігаєте зміни в пробірці? Зробіть висновок.
Бесіда
Пригадайте варене яйце чи скисле молоко. Чи можливо повернути їх у первісний стан?
(Ні, бо це необоротний процес)
Дослід 2.
До молока (3 мл в пробірці) прилити 1 мл розчину СН3СООН. Простежте процес згортання казеїну (білок молока). Зробіть висновок. Де спостерігаємо подібний процес в побуті? .
( На основі концентрату харчового казеїну розроблена технологія сметани низької жирності і кисломолочних напоїв. Поряд з властивістю казеїну згортатися під дією сичужного ферменту його використовують при виробленні кисломолочних продуктів і сиру. Гідрофільні властивості казеїну і продуктів його розпаду також визначають водозвязуючу і волого утримуючу здатність сирної маси при дозріванні сиру, тобто консистенцію готового продукту).

Вплив температури
![]()

![]()


![]()
![]()
![]()

Як ви вважаєте, чому в разі отруєння солями важких металів як протиотруту застосовують яєчний білок чи молоко?
( Білки осаджують ці солі, денатурують).
• Як довести, що молоко та кисломолочний сир містять білки?
• Дослід № 3. Ксантопротеїнова реакція. «Визначення білків у твердому сирі»
Відповідь: під час дії на білки концентрованої нітратної кислоти вони забарвлюються у жовтий колір. Це ксантопротеїнова реакція. Вона доводить, що до складу білків входять залишки ароматичних амінокислот. (Дослід: сир + НNО3(конц.)+нагрівання =жовте забарвлення.)
До 1 мл розчину білку додайте 8 крапель концентрованої нітратної кислоти, нагрійте суміш до кипіння і прокип’ятіть 1-2 хв. Спостерігайте появу розчину жовтого кольору. Охолодіть суміш і обережно додайте 2 мл КОН. Колір стане жовто-гарячим завдяки альбумін ату. Чим пояснити, що ксантопротеїнова реакція дає жовтий колір?
Дослід № 4. Біуретова реакція. « Визначення білків у морозиві».
Методика проведення
У пробірку наливають 1 мл розчиненого морозива і додають 5-7 мл води, закривають її пробкою і струшують. До отриманої суміші доливають розчин NaOH і декілька крапель розчину СuSO4. Вміст пробірки струшують. Зявляється яскраво-фіолетове забарвлення, що свідчить про наявність білка у морозиві.
Налийте в дві пробірки по 1 мл білка і концентрованого розчину КОН, також 1 краплю насиченого розчину сульфату міді (CuSO4). Вміст пробірки струсити та простежити зміну забарвлення,спостерігайте появу розчину фіолетового кольору. На наявність яких груп вказує колір?
Властивості білку можуть сильно змінюватися при заміні однієї амінокислоти іншою. Це пояснюється зміною конфігурацій пептидних ланцюгів і умов утворення просторової структури білка, яка кінець кінцем визначає його функції в організмі.
6. Функції білків: заповнити таблицю, використавши роздатковий матеріал.
Функції білків
|
Функція |
Характеристика |
|
Ферментативна (біокаталіз) |
Ферменти забезпечують перебіг хімічних реакцій у клітині за низьких температур, невисокого тиску і дуже малих концентрацій. Ферменти прискорюють перебіг біохімічних процесів у 100 -1 000 разів порівняно з тими, які відбуваються у середовищі без ферментів. |
|
Будівельна (структурна) |
Основний структурний матеріал клітини (мембран, органоїдів З них складаються структури, які виконують роль скелета клітин. Головним компонентом хрящів і сухожилків є пружний міцний білок колаген. Волокна, що складаються з цього білка, є у багатьох різновидах сполучної тканини і надають їм міцності. Пружності кісткам надає білок осеїн. |
|
Захисна |
Білки-антитіла здатні «розрізнювати» і знищувати хвороботворні мікроорганізми. Білки ядра гістони захищають молекули ДНК від ушкоджень. Білкові фактори згортання крові захищають організм від крововтрат. Наприклад, особливі захисні білки - імуноглобуліни, або антитіла, що утворюються в організмі хребетних тварин і людини, здатні «впізнавати» та знешкоджувати бактерії, віруси, чужорідні для організму білки. Білки крові - фібрин, тромбопластин і тромбін - беруть участь у процесах її зсідання, що запобігає великим крововтратам у разі ушкодження стінок кровоносних судин.
|
|
Регуляторна (гуморальна, гормональна) |
Поряд із нервовою системою гормони білкової природи керують роботою різних органів і всього організму через систему хімічних реакцій. |
|
Сигнальна |
Окремі складні білки клітинних мембран, змінюючи свою структуру, передають сигнали із зовнішнього середовища на інші ділянки мембрани або всередину клітини. Так вони здійснюють сигнальну функцію |
|
Скорочувальна (рухова) |
Усі види рухів виробляються особливими видами скорочувальних білків. Скоротливі білки актин і міозин, які входять до складу м'язових та деяких інших клітин, забезпечують їхню здатність до скорочення . Білок тубулін входить до складу мікротрубочок - компонентів джгутиків і війок певних клітин еукаріотів.
|
|
Транспортна |
Транспортні білки крові переносять кисень та органічні речовини. Гемоглобін - дихальний пігмент крові людини, хребетних і багатьох безхребетних тварин - переносить кисень і деяку частку (до 10%) вуглекислого газу. Цим забезпечується газообмін у клітинах і тканинах. |
|
Енергетична |
При окисненні 1 г білка вивільняється 17,2 кДж енергії |
|
Запасаюча |
Деякі білки можуть відкладатись у клітинах про запас, наприклад, білок овальбумін, що накопичується у білковій оболонці пташиних яєць. Його споживає пташеня перед виходом з яйця. |
7. Поняття про ферменти.
Ферменти (від лат. ферментум - закваска), яких відомо понад 6 000, - це прості (однокомпонентні) або складні (двокомпонентні) білки. Складні білки, на відміну від простих, містять ще й небілкову частину у вигляді певних органічних сполук (наприклад, похідних вітамінів), катіонів або аніонів.
Білкова частина молекули ферменту визначає його специфічність щодо речовин, реакцію за участю яких цей фермент каталізує. Але активність складних ферментів виявляється лише тоді, коли його білкова частина сполучається з небілковою. Каталітичну активність ферменту зумовлює не вся його молекула, а лише її невелика ділянка - так званий активний центр. Його структура відповідає хімічній будові речовин, які вступають у реакцію. В одній молекулі ферменту може бути кілька активних центрів.
Ферменти прискорюють перебіг біохімічних процесів у 100 -1 000 разів порівняно з тими, які відбуваються у середовищі без ферментів. Завдяки ферментам енергія, необхідна для перебігу реакції, менша, ніж без їхньої участі (мал. 1).
Мал. 1. Схема дії ферменту
Активність ферментів виявляється лише за відповідних умов: певної температури, тиску, кислотності середовища тощо. Ферментативні реакції відбуваються у кілька послідовних етапів. Ланцюги взаємопов'язаних ферментативних реакцій забезпечують нормальний перебіг процесів обміну речовин і перетворення енергії в організмі.
Ферменти (зокрема їхні активні центри) утворюють нестійкий комплекс з речовинами, які вступають у реакцію. Цей комплекс згодом швидко розпадається з утворенням продуктів реакції. Сам фермент при цьому свою структуру, а відповідно і активність, не втрачає і здатний каталізувати наступну подібну реакцію.
У клітині багато ферментів пов'язано з плазматичною мембраною або мембранами окремих органел (мітохондрій, пластид тощо). Деякі ферменти беруть участь у транспортуванні речовин через мембрани.
V. Узагальнення та систематизація знань .
Метод: виконання самостійної роботи у вигляді тестів.
VІ. Підсумок заняття
Аналіз роботи студентів на занятті (усний). Виставлення оцінок.
Тестова форма контролю знань
Тема: Білки їх будова, властивості,функції. Ферменти
Тести
В - 1
1. Вкажіть, білки – високомолекулярні полімери мономерами яких є:
А нуклеотиди ;
Б амінокислоти;
В моносахариди;
Г кислоти.
2. Вкажіть скільки амінокислот синтезують молекулу білка:
А 20;
Б 21;
В 24;
Г 18.
3. Вкажіть як називається група атомів за якою амінокислоти різняться між собою:
А аміногрупа;
Б карбоксильна група;
В за кислотними властивостями;
Г радикалом.
4. Фермент у процесі реакції:
А не змінюється, але витрачається; В змінюється і витрачається;
Б не змінюється і не витрачається; Г змінюється але не витрачається
5. Вкажіть, як називається процес порушення природної структури білків:
А деструкція; В глобуляція;
Б фібриляція; Г денатурація.
6. Вкажіть , які зв’язки лежать в основі утворення первинної структури білка:
А водневі;
Б пептидні;
В ковалентні;
Г не існують взагалі.
Завдання мають на меті встановлення відповідності , послідовності та містять завдання з відкритою відповіддю
7. Встановіть відповідність між білком і функцією , яку він виконує:
А гемоглобін 1 зсідання крові
Б міозин 2 захисні білки
В тромбін 3 скоротливі білки
Г імуноглобулін 4 перенесення кисню
8. Встановіть відповідність між структурою білка і її характеристикою:
А первинна 1 закручення спіралі у глобулу
Б вторинна 2 молекула у вигляді ланцюга
В третинна 3 поєднання глобул
Г четвертинна 4 частково скручується у спіраль
9. Встановіть відповідність між терміном і визначенням амінокислот:
А прості 1 в організмі не синтезуються
Б замінні 2 в організмі синтезуються
В складні 3 складаються тільки з амінокислотних залишків
Г незамінні 4 у складі мають залишки вуглеводів і ліпідів
10. Встановіть відповідність між терміном і визначенням :
А сполуки розчинні у воді 1 денатурація
Б розгортання поліпептидного ланцюга 2 деструкція
В порушення первинної структури 3 ренатурація
Г поновлення структури 4 гідрофільні сполуки
Тестова форма контролю занань
Тема: Білки їх будова, властивості, функції. Ферменти
Тести
В - 2
1. Вкажіть як називається особливий захисний білок у хребетних:
А міозин;
Б гемоглобін;
В імуноглобулін;
Г тубулін.
2. Ренатурацією називають:
А штучний синтез білкової молекули;
Б руйнування четвертинної та третинної структури білка;
В зворотний перехід молекул біополімеру з денатурованого стану в нативний;
Г процес спонтанного утворення вторинної та третинної структури білка після закінчення процесу трансляції
3. Вкажіть хімічний зв'язок, за допомогою якого утворюється вторинна структура білка:
А йонний; В водневий;
Б гідрофобний; Г пептидний
4. Захисна функція білків полягає в:
А захисті внутрішніх органів від механічних пошкоджень;
Б утворенні антитіл під час імунної відповіді;
В вибірковій проникності клітинних мембран;
Г захисні клітини від проникнення води й різних речовин
5. Вказати просторову форму поліпептидних ланцюгів у молекулі ДНК
А витягнута
Б скручена у вигляді спіралі
В замкнуті ланцюги
Г у вигляді глобули кислотних ланок
6. Пояснити чим визначається індивідуальність білка:
А Амінокислотним складом
Б суворою послідовністю розміщення амінокислотних ланок
В багаторазовим повторення амінокислотних ланок
Завдання мають на меті встановлення відповідності , послідовності та містять завдання з відкритою відповіддю
7. Встановіть відповідність між білком і функцією, яку він виконує:
А кератин 1 білок яйця птахів
Б овальбумін 2 входить до складу волосся і нігтів
В осеїн 3 відповідає за скорочення м’язів
Г актин 4 забезпечує пружність кісток
8. Встановіть відповідність між структурою і типом хімічного зв’язку у молекулі:
А первинна 1 водневий
Б вторинна 2 іонний
В третинна 3 ковалентний
Г четвертинна 4 гідрофобні взаємодії
9. Встановіть відповідність між органом і вмістом у ньому білків:
А м’язи 1 45%
Б печінка 2 28 %
В мозок 3 80 %
Г кістки 4 57 %
10. Встановіть послідовність у визначенні функцій ферментів:
А пришвидшують біохімічні реакції;
Б будівельна; В енергетична ; Г активність проявляється за певних умов.


про публікацію авторської розробки
Додати розробку