Блок»Періодичний закон та Періодична система хімічних елементів. Будова атому»
Блок: «Періодичний закон та Періодична система. Будова атому.»
«Періодичному закону майбутнє не погрожує руйнуванням, а лише надбудову та розвиток обіцяє.» Д.И.Менделєєв
Основні питання: _
1.Класифікація хімічних елементів.
2.Періодичний закон Д.І.Менделєєва.
|
1.1 |
В кінці VIII ст. А.Л.Лавуаз’є поділив елементи на метали неметали. |
МЕ ? НЕМЕ … … … |
|
1.2 |
Лужні метали- це прості речовини, утворені елементами IА групи. Вони м’які, легкоплавкі. Активно реагують з киснем: 2К+ О2→К2О2(пероксид); з водою створюють луги. |
IА:………………………… Na + О2→…………….. K + H2O→……………. |
3. Періодична система хімічних елементів Д.И.Менделєєва.
4.Радіоактивність. Планетарна модель атому. Будова ядра . Ізотопи.
Ядерні реакціі.
5.Стан електронів в атомі.
6.Періодична система та будова атому. Взаємозв‘язок між положенням у Періодич ній системі та властивостями елементів, простих та складних речовин. Характер истика елементів за положенням в Періодичній системі та будовою атому .
7.Значення Періодичного закону та Періодичноі системи Д.И.Менделєєва.
Поняття:
лужні метали; лужноземельні метали; галогени; інертні гази; Періодична система Д.І.Менделєєва; період; група; підгрупа; радіоактивність; атом; протони; нейтрони; ізотопи; ядерна реакція; протонне число; нуклонне число; нукліди; енергетичні рівні; спін; орбіталь(електронна хмара); неспарений електрон; спарений електрон;
збуджений атом; електронна формула, графічна формула.
Закони: Періодичний закон Д.И.Менделєєва; сучасне формулювання Періодичного закону Д.І.Менделєєва.
Література: П.П.Попель,Л.С.Крикля, «Хімія 8 клас», §1-12. Блок.
|
|
2Li+ 2H2O→2LiOH + H2 |
|
|
|
1.3 |
Лужноземельні метали --це елементи IIА групи, окрім берилію та магнію.Усі при нагревані реагують з киснем, утворюючи оксиди. Берилій з водою не реагує, магній реагує з водою за умов нагрівання : Mg +2H2O→Mg(OH)2+ H2 |
IIА:……………………… Ba+ О2→ Ca+ H2O→ Sr + H2O→ |
|
|
1.4 |
Елементи VI А групи - халькогени, «ті що утворюють руду». З воднем та металами проявля ють валентність II, а в сполуках з киснем та іншими неметалами- IV, VI. |
VIА:………………………… Прості речовини:………… гідриди:………………… оксиди:…………………… |
|
|
1.5 |
Галогени- це елементами VII А групи. Галогени реагують з воднем, утворюють галогеноводні НX: H2+F2→2HF Розчини галогеноводнів- кислоти . Галогени« солетворні»,так як з металами утворюють солі: F2 + 2K→2KF В оксидах проявляють валентності: I, III , V, VII -Е2О, Е2О3, Е2О5, Е2О7 ,виключення: F (I)-F2O |
VIIА :………………………. Прості речовини:………… Гідриди……………. Оксиди……..,,,,,,, Cl2+ H2→…. Br2+ H2→…. Cl2+Na → … . Br2+Ca→…. |
|
|
1.6 |
Інертні гази-прості речовини, утворені атомами елементів VIII А групи. |
VIII А:………………………. прості речовини……………. |
|
|
2.7 |
Властивості хімічних елементів, а также форми та властивості іх сполук знаходяться в періодичній залежності від атомної ваги елементів. |
Періодичний закон 1971р. Д.І.Менделєєв |
|
|
3.8 |
Періодична система- наукова класифікація хімічних елементів, графічне відображення Періодичного закону. |
1968р. |
|
|
3.9 |
Періоди- горизонтальні ряди, в яких посилюються неметалеві властивості. Усі періоди починаються металами а завершуються інертними газами. Малі періоди відрізняються від великих: а)кількістю елементів; б)в малих періодах властивості від Ме до НеМЕ змінюються різко, а у великих плавно; в) в малих періодах валентність в оксидах зростає від I доVII,а у великих періодах спочатку зростає до VII, а потім відбувається різке падіння до 1 та знову зростання до 7. |
1-3- Малі 4-7- великі 3період……… I група Na…………… K_________ Cu…………… |
…………….. VIIгрупа Cl…. Mn__ Br |
|
3.10 |
Групи- вертикальні стовпчики. Головна підгрупа містить елементи малих та великих періодів, а побічна-великих періодів. В головних підгрупах зверху вниз посилюються металеві властивості . Номер групи вказує на: 1)вищу валентність в оксидах; |
Валентність в оксидах: Сu -….,Ag-…, Au-…, F…, VIIIБ-… Виключення ………………………… |
|
|
|
2)валентність елементів у гідридах до IV групи дорівнює номеру групи, а після IV групи дорівнює різниці: 8-номер групи. |
S- SO3 H2S P- … … |
||
|
3.11 |
Неметали розміщено над діагоналлю B- At в головних підгрупах. |
B At |
||
|
4.12 |
Радіоактивність- це самовільне випромінювання атомами елементарних частинок. |
1896р. А.Бекерель… 1903р. RaCl2…. |
||
|
4.13 |
Атоми хімічних елементів–це нейтральні частинки, які складаються із позитивного ядра та негативних електронів. Весь позитивний заряд та маса зосереджені в ядрі атому. |
Е. Резерфорд, планетарна модель атому 1911 р. B +5 5е S ………………….. |
||
|
4.15 |
Ядро атому складається із протонів та нейтронів (нуклонів). Число протонів у ядрі атому елементу дорівнює порядковому номеру елементу - Z. Заряд ядра – це число протонів:p=Z Маса ядра -це сума протонів та нейтронів. Ar = p+n. n= Ar –p |
B Z=5 p=5 n=11-6=5 S Z= e= …р=… n=… . |
||
|
4.16 . |
Хімічний елемент – вид атомів з певним протон ним числом. Протонне число-кількість протонів. Його вказують зліва внизу від символу елементу. Нуклонне (масове)-сума протонів та нейтронів. його вказують зверху злів від символу елемента. 1327Al Нуклід - вид атому з певним протонним та нуклонним числом. |
Запиши нукл S C Na P |
іди: Mg |
|
|
4.17 |
Йонни- це позитивні та негативні частинки, які утворюються внаслідок віддачі або приєднання атомом електронів. Катіони- позитивні частинки, що утворюються, коли атом віддає електрони: Na0 -1e= Na+ Аніони- це негативні частинки, що утворюються внаслідок прийняття атомом електронів: S0+2e= S2- |
Ca2+ N3- …… Al3+ C4- |
|
|
|
4.18 |
Ізотопи- різновидність атомів певного хімічного елементу з різними масовими числами.Ядро ізотопів містить однакову кількість протонів, але різну кількість нейтронів. Ізотопи гідрогену: 11Н - протій 12Н - дейтерій -D 13Н. - тритій. -T |
11Н. p =. 1. n=. … |
1 H. 2 1. … |
3 1 H 1 … |
|
|
|
Ar=. … … … |
||
|
4.18 **i |
Ізобари- види атомів, що мають різне протонне число, але однакове нуклонне число.( маса однакова у різних хімічних елементів) |
… |
||
|
4.19 |
Відносна атомна маса хімічних елементів - є середнє масове число природних сумішей ізотопів: Ar (Е)= χ1 •. Аr(1) + χ2 ·Аr (2) + …χn ·Аr (n) , де χ1, χ2 -атомні відсотки ізотопів у природі; Аr((1), Аr (2) -відносні атомні маси ізотопів. χ (назва: хі, греч. χι) |
63Cu и 65Cu. Приклад: Аr(Сu)-? χ (63Cu)=72,5%; χ (65Cu)=27,5% Ar(Cu)=χ (63Cu)· Ar(63Cu)+ χ (65Cu)· Ar(65Cu) =0,725· 63+0,275·65=63,55 |
||
|
4.20 |
Ядерні реакціі- перетворення ядер атомів одних елементів в інші. Першу штучну реакцію було проведено Е.Резерфордом в 1919 році при бомбардуванні ядер нітрогена альфа частинками. |
14 '7 N |
+ 24He→817O +11H |
|
|
4.20 *** |
Правило складання ядерних реакцій: а) сума нуклонних чисел реагентів дорівнює сумі нуклонних чисел продуктів; б) сума протонних чисел реагентів дорівнює сумі протонних чисел продуктів. |
'714N + 24He→817O +11H 14+ 4= 17+ 1 7+ 2= 8+ 1 Застосовуй частинки: Протони…. Нейтрони… Дейтерій… Тритій… Альфа…… електрони(бета )….. |
|
|
|
5.21 |
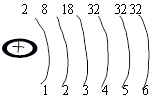
Електрони мають різний запас енергії тому розміщуються на різних енергетичних рівнях. n-головне квантове число,яке відповідає номеру рівня та приймає значення: n=1,2,3,4,5,6,7 Кількість е л е к т р о н і в н а енергетичному рівні визначаємо за формулою: N=2n2, що вірно для n= 1-4 |
|
7 |
|
|
5.22 |
Кількість енергетичних рівні в а т о м і відповідає номеру періоду,в якому міститься хімічний елемент. Приклад: Р-3 період - його 15 електронів розміщуються на 3періодах. Кількість електронів на зовнішньому рівні у елементів головних підгруп дорівнює номеру групи. |
Р +15, 15е 3період-3рівня На рівнях: 2е 8е 5е B +5, 5е 2період На двох рівнях: 2е 3е Не………………. О………….. |
||
|
5.23 |
В атомах елементів великих періодів спочатку заповнюємо зовнішній рівень а потім передостанній , керуючись правилами: а)у елементів побічних підгруп на зовнішньому рівні 2е (виключення Cr, Ag,Au,Cu - 1е );ц б)у елементів головних підгруп на зовнішньому |
Cr…… Br…….. |
||
|
|
рівні кількість електронів дорівнює номеру групи. Fe +26, 26 е 2 е 8 е (26-12)__ 2 е As +33, 33е 2е 8е (33-15)___ 5е |
|
|
5.24 |
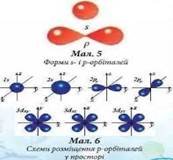
Область, в якій знаходження електрону найбільш ймовірне, називається електронна орбіталь або електронна хмара. Орбіталі мають різну геометричну форму. Розрізняють:s-орбіталь; p-орбіталь; d- та f- орбіталі. |
|
|
5.25 |
Рух електрону навколо власної осі характеризується спіновим квантовим числом: S=+1/2, -1/2. На одній орбіталі можуть знаходитися 2електрони з протилежними спінами.Неспарений електрон-це один електрон на орбіталі. |
Орбіталь-комірка ↓□ неспарений електрон ↓↑□ спарені електрони |
|
5.26 |
Кожна орбіталь має відповідну кількість рівноцінних орієнтацій у просторі: s-1 p-3 d-5 f- 7 Відповідно ел.= 2е 6е 10е 14е Тому, відповідно до кількості електронів, існує певна кількість орбіталей на кожному рівні на 1рівні- s 2е 1s2 на 2рівні-s p 8е 2s2 Р6 на 3рівні-s p d 18е 3s2p6 d10 на 4рівні-s. p d f 32е 4s2 p6 d10 f14 |
|
|
5.27 |
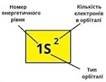
Електронна формула- це запис,що відображає розміщення електронів в атомі за енергетичними рівнями.
Приклад: Р +15, 15е Розміщення за рівнями: 2е 8е 5е 1S2 2S2P6 3S2P3 |
Приклад: Р +15, 15е Розміщення за рівнями: 2 е 8 е 5 е 1S2 2S2P6 3S2P3 Приклад: О +8, 8е Розміщення за рівнями: 2е 6е 1s2. 2s22p4 N …………. …………. |
|
5.28 |
Електрон в атомі розміщуються так, щоб енергія була мінімальною. Орбіталі заповнюються в поряку зростання іх енергіі: 1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d " 4f < 6p < 7s. |
Fe +26. 26e 2e. 8e. 14e. 2e 1s2. 2s22p6 3s23p 6 4 4s2 3d6 Cr…………………. |
|
5.29 |
Графічна формула атому- це запис, що відображає розміщення електронів за електронними комірками. |
|
|
|
Число неспарених електронів повинно бути максимальним. Елементи класифікують відповідно до орбіталей, які в них заповнюються на : s- елементи, p-, d-, f- елементи. Iа,ІІАгрупи-s-елементи ІІІА- VIIIAгрупи- p-елементи ІБ- VIIIБ групи- d-елементи Лантаноіди та актиноіди- f-елементи. |
P …… S… |
|
5.30 |
Електрони можуть переходити в збуджений стан за наявності вільних(вакантних) орбіталей на зовнішньому енергетичному рівні. При цьому розпарюються спарені електрони, займають вільну орбіталь і збільшується кількість неспарений електронів. |
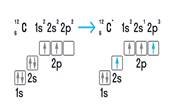
ІІ С 2S2 2P2 →
ІV C* 2S1 2P3
………… Cl………… |
|
6.31 |
Вища валентність елементів - це кількість неспаре них електронів. |
С-ІІ , IV. O- II |
|
6.32 |
Сучасне формулювання Періодичного закону: Властивості хімічних елементів, а також склад та властивості іх сполук, знаходяться в періодичній залежності від значення зарядів іх атомів. |
Г.Мозлі встановив заряди ядер атомів хімічних елементів. |
|
6.33 |
Фізична с у т ь П е р іодичного з а к о н у: із збільшенням зарядів атомних ядер періодично змінюється будова атому, що зумовлює періодичну зміну хімічного характеру елементів,іх валентності та властивості простих та складних речовин. |
Li +3 2e. 1e. Na+11. 2e. 8e. 1e. K+19 2e. 8e. 8e. 1e C… Si |
|
6.34 |
Номер групи вказує на кількість електроні в на зовнішньому енергетичному рівні елементів головних підгруп та на вищу валентність елементів (виключення F, O та елементи VIII, крім Оs та Ru). |
IA група Li 2e. 1e Na 2e 8e 1e ………… K 2e 8e 8e 1 e запальная формула nS1 |
|
6.35 |
Металеві властивості -це здатність атомів віддавати електрони. Неметалеві властивості-здатність атомів приймати |
Na0 -1e →Na1+ S0+2e→S2- Mg … |
|
|
електрони. |
P…………….?С |
||
|
6.36 |
У групі із збільшенням порядкового номеру посилюються металеві властивості тому, що збільшується атомний радіус. Самий активний метал - францій У п е р і о д і із збільшенням порядкового номеру послаблюються металеві властивості та посилюються неметалеві так, як збільшується заряд ядра та кількість електронів, зменшується радіус. Самий активний неметал- фтор. |
Ме Амф. Неметали Li Be. B. C N О F +3,3+4,4+5,5+6,6+7,7+8,8+9,9 Li +3,3e. 2e. 1e . Na+11,11e 2e. 8e. 1e. К+19, 19е 2е. 8е. 8е. 1е. Fr . . . . . . 1e. |
||
|
6.37 |
Кислотні властивостівищих оксидів та гідроксидів посилюються в періодах зліва направо, а в головних підгрупах-знизу вверх. Основні властивості оксидів та гідроксидів посилюються в протилежну сторону. |
осн амф. Кислотні Li2O BeO B2О3 СО2 N2О5 Аl2O3. Si2O3 LiOH. H3ВО3. H2СО3 НNO3 осн. Кислоти |
||
|
6.38 |
Гідриди металів - йонні речовини. Гідриди неметалів- молекулярні, леткі сполуки. NaH MgH2 AlH3 SiH4 PH3 H2S HCl Тв Тв. Тв Газ газ газ газ Валентність в гідридах елементів до IV групи дорівнює номеру групи, а після IV групи В= 8- номер групи приклад: нітроген в V групі, В= 8-V=ІІІ тому формула гідриду нітрогену: NH3 |
Складіть формули гідридів S…. O… P… Na… |
||
|
6.39 |
Загальні фор елементів: І групаІІ групаІІІ групаIV група- V групаVI групаVII група- |
мули окси Е2О ЕО Е2O3. EO2. E2О5. ЕО3. Е2O7. |
дів та гідроксидів хімічних ЕОН - основа Е(OH)2 -основа Е(ОН)3, H3EO3 Н2ЕО3 Н3ЕО4 Н2EО3 НЕО4 |
S Вищий оксид.. Гідроксид Р Вищий оксид… Гідроксид… |
|
6.40 |
План- характеристика хімічних елементів. I.Положення елементу в Періодичній системі 1.Хімічний символ елементу та належність його до металів, неметалів, амфотерних елементів. 2.Порядковий номер елементу 3.Номер групи, підгрупа 4.Номер періоду(малий або великий) 5.Вища валентність в сполуках з оксигеном, формула |
Приклад: 1. Mg-метал 2.12 3.II група, головна підгрупа 4.3 період, малий 5.II, MgO; II, MgH2 6. 1224Mg |
||
|
|
вищого о к с и д у. В а л е н т н іс т ь у с полуках з гідрогеном, формула гідриду. формула гідроксиду елементу. II.Будова атому. 6.Формула нукліду 7.Заряд ядра та кількість електронів 8.Кількість протонів, нейтронів 9.Розміщення електронів за енергетичними рівнями 10.Електронна формула атому 11.Графічна формула атому III.Висновок 12.До якої групи елементів належить елемент (s,p,d,f-элемент) 13.Вища валентність 14.Характер та властивості вищого оксиду 16.Формула гідроксиду 17.Характер та властивості гідроксиду |
7.+12,12е 8. р=12, п=12 9. 2е 8е 2е 10. 1S22S22P63S2 11.Валентні електрони: 12.S-елемент 13 II, MgO, 14. MgO-основни оксид 3MgO+P2O5→Mg3(PO4)2 3MgO+2H3РО4 Mg3(PO4)2+ 3H2O 16.Mg(OH)2 -основа 17. 3Mg(OH)2+2H3PO4 Mg3(PO4)2 + 6H2O |
3S2 → → |
|
6.41 |
Періодичний закон та Періодична система Д.І.Менделєєва демонструють основні закони розвитку природи: розвиток по спіралі, перехід кількості в якість, єдинство та боротьба протилежностей. Приклади п.6.34, 6,36 |
Розмісти метали ІА груп спіралі…. . |
и на |


про публікацію авторської розробки
Додати розробку


 :
: