Дистанційний курс "Кількість речовини.Розрахунки за хімічними фпрмулами."
- хімічних задач. Їх розв'язування являється одним із шляхів об'єднання теорії з практикою, активізації навчальної діяльності учнів при вивченні основ хімії. Систематичне розв'язання задач дає можливість досягти основної дидактичної мети навчання: досягти глибоких і міцних знань, стійких умінь і навичок, розвивати логічне мислення. Практика показує, що ефективним є поетапне формування і розвиток умінь учнів розв'язувати розрахункові задачі. Він полягає в тому, що спочатку розбирається зразок задачі, форма запису. Потім повторюються показані дії учнями. Наступним кроком є закріплення виконаних дій шляхом розв'язування аналогічних задач та обернених ним. Далі, коли учні навчилися розв'язувати типові задачі, починається етап розвитку вмінь, який реалізується шляхом розв'язування складніших (на кілька дій), комбінованих задач, розв'язування задач кількома способами. Творчим вже є етап самостійного складання і розв'язування задач. Одним із прийомів активізації пізнавальної діяльності учнів під час розв'язування задач є використання алгоритмів дій. Алгоритмізація активно використовується у цьому дистанційному курсі.
1
ДИСТАНЦІЙНИЙ КУРС З ХІМІЇ ДЛЯ 8 КЛАСУ «КІЛЬКІСТЬ РЕЧОВИНИ. РОЗРАХУНКИ ЗА ХІМІЧНИМИ ФОРМУЛАМИ»
Виконала учитель хімії
Харківської спеціалізованої
Школи І-ІІІ ступенів №17
Харківської міської ради
Харківської області
Локтіонова А. О.
Харків 2020
ЗМІСТ
Інструктивно-методичні рекомендації щодо опанування дистанційним курсом
Заняття №1 « Повторення основних питань хімії 7 класу. Найважливіші поняття хімії»
Теоретичний матеріал до заняття №1
Тест самоконтролю до заняття №1
Критерії оцінювання до тесту для самоконтролю заняття №1
Відповіді до тесту самоконтролю заняття №1
Заняття №2 «Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро»
Теоретичний матеріал до заняття №2
Практичне застосування щодо реалізації набутих теоретичних знань.
Тест самоконтролю до заняття №2
Критерії оцінювання до тесту для самоконтролю заняття №2
Відповіді до тесту самоконтролю заняття № 2
Теоретичний матеріал до заняття №3
Практичне застосування щодо реалізації набутих теоретичних знань.
Тест самоконтролю до заняття №3
Критерії оцінювання до тесту для самоконтролю заняття №3
Відповіді до тесту самоконтролю заняття №3
Практичне застосування щодо реалізації набутих теоретичних знань.
Заняття №5 «Молярний об’єм газів. Закон Авогадро.»
Теоретичний матеріал до заняття №5
Практичне застосування щодо реалізації набутих теоретичних знань.
Тест самоконтролю до заняття №5
Критерії оцінювання до тесту для самоконтролю заняття №5
Відповіді до тесту самоконтролю заняття №5
Заняття №6 «Обчислення об’єму певної маси або кількості речовини відомого газу за нормальних умов.»
Теоретичний матеріал до заняття №6
Практичне застосування щодо реалізації набутих теоретичних знань.
Заняття №7 «Відносна густина газів.»
Теоретичний матеріал до заняття №7
Практичне застосування щодо реалізації набутих теоретичних знань
Тест самоконтролю до заняття №7
Критерії оцінювання до тесту для самоконтролю заняття № 7
Відповіді до тесту самоконтролю заняття № 7
Теоретичний матеріал до заняття №8
Практичне застосування щодо реалізації набутих теоретичних знань. Алгоритм розв'язання задач
Узагальнюючий тест з теми: «Кількість речовини. Розрахунки за хімічними формулами»
Критерії оцінювання до тесту для самоконтролю заняття № 8
Відповіді до тесту самоконтролю заняття №8
Задачі дистанційного курсу
Для якісного засвоєння знань з хімії велика роль відводиться всім типам хімічних задач. Їх розв’язування являється одним із шляхів об’єднання теорії з практикою, активізації навчальної діяльності учнів при вивченні основ хімії. Систематичне розв’язання задач дає можливість досягти основної дидактичної мети навчання: досягти глибоких і міцних знань, стійких умінь і навичок, розвивати логічне мислення. Практика показує, що ефективним є поетапне формування і розвиток умінь учнів розв’язувати розрахункові задачі. Він полягає в тому, що спочатку розбирається зразок задачі, форма запису. Потім повторюються показані дії учнями. Наступним кроком є закріплення виконаних дій шляхом розв’язування аналогічних задач та обернених ним. Далі, коли учні навчилися розв’язувати типові задачі, починається етап розвитку вмінь, який реалізується шляхом розв’язування складніших (на кілька дій), комбінованих задач, розв’язування задач кількома способами. Творчим вже є етап самостійного складання і розв’язування задач.
Одним із прийомів активізації пізнавальної діяльності учнів під час розв’язування задач є використання алгоритмів дій. Вони можуть бути як текстовими, так і знаковими. Під алгоритмом у педагогічній психології зазвичай розуміють послідовності інтелектуальних операцій, необхідних і достатніх для вирішення будь-якої із завдань, що належать до певного класу. Психологи підкреслюють, що для ефективного навчання ці операції треба виявити і спеціально їм навчати. Це не менш необхідно, ніж навчання самим правилами. Без оволодіння операційної стороною мислення знання правил часто-густо виявляється марним, бо учень не в змозі їх застосувати. Задача нашого курсу сформувати уявлення учнів про хімічне поняття «кількість речовини», «молярна маса», «молярний об'єм»; формувати вміння застосовувати набуті знання під час розв’язування розрахункових задач з використанням алгоритмів.
Інструктивно-методичні рекомендації щодо опанування дистанційним курсом
1. Ознайомитесь з темою та метою заняття.
2. Прочитайте алгоритм роботи з даним заняттям.
3. Опрацюйте теоретичний матеріал заняття.
4. Узагальніть заняття за допомогою створення опорного конспекту.
5. Перегляньте презентацію та відеоматеріал до заняття.
6. Дайте відповідь на завдання для самоконтролю та відправите їх на перевірку вчителю.
7. Виконайте практичні завдання та відправите їх на перевірку вчителю.
8. Перевірте свої знання за допомогою тестів самоконтролю.
9. Після вивчити всього курсу пройдіть контрольний тест.
Заняття №1 « Повторення основних питань хімії 7 класу. Найважливіші поняття хімії»
Тема: « Повторення основних питань хімії 7 класу. Найважливіші поняття хімії»
Мета: повторити найважливіші поняття хімії, що були розглянуті під час вивчення хімії в 7 класі: «речовина», «атом», «молекула», «йон», «хімічний елемент», «відносна атомна й молекулярна маси», «прості та складні речовини», «хімічна формула», «фізичні й хімічні явища», «хімічні рівняння»;сприяти активізації пізнавальної діяльності учнів, розвивати їхню самостійність в опануванні знань; виховувати творчу, допитливу особистість.
Інструкція до заняття №1
Для успішного вивчення теми заняття №1« Повторення основних питань хімії 7 класу. Найважливіші поняття хімії» необхідно:
1.Вивчити теоретичний матеріал.
2. Переглянути презентацію « Основні поняття хімії».
3. Зробити опорний конспект
4. Вивчити основні поняття.
5. Виконати практичне завдання
6. Відповісти на питання тесту для самоконтролю « Основні поняття хімії».
Теоретичний матеріал до заняття №1
Хімія — наука про речовини, їх властивості, перетворення та явища, що супроводжують ці перетворення.
Речовини — це те, із чого складаються фізичні тіла.
Речовини, що існують у природі, постійно зазнають різних змін.
Фізичні явища — це явища, що не супроводжуються перетвореннями одних речовин на інші (зазвичай змінюється агрегатний стан речовин або їхня форма).
Хімічні явища — це явища, у результаті яких з певних речовин утворюються інші.
Властивості речовин — це ознаки, що дозволяють відрізнити одні речовини від інших або встановити подібність між ними.
Усі речовини, що існують у природі, являють собою сукупність частинок (атомів, молекул, йонів).Кожна речовина залежно від умов (температури, тиску) може перебувати в певному агрегатному стані.
Атом — дрібна електронейтральна хімічно неподільна частинка речовини, що складається з позитивно зарядженого ядра й негативно зарядженої електронної оболонки.
Електрон — одна з елементарних частинок негативним зарядом.
Атомне ядро — центральна, позитивно заряджена частина атома, що складається з нуклонів, зв’язаних між собою ядерними силами.
Йон- атом, що має електричний заряд.
Хімічний елемент — вид атомів з певним зарядом ядра.
Молекула — найменша частинка речовини, що характеризується його хімічними властивостями.
Склад речовин молекулярної будови прийнято виражати з допомогою хімічних формул. Під час хімічних реакцій відбувається перегрупування атомів. Саме в перегрупуванні атомів і утворенні нових речовин полягає суть хімічної реакції.
Реагенти —› Продукти
Але для конкретних речовин маємо певні хімічні формули. Хімічну реакцію можна записати за допомогою хімічних формул у вигляді схеми:
С + О —› СО2
Вугіллявзаємодіє зкиснем з утворенням вуглекислого газу Цей схематичний запис називається схемою хімічної реакції.У лівій частині наведеного рівняння записаний один атом Карбону й одна молекула кисню, що складається з двох атомів Оксигену – це реагенти. У правій частині записана одна молекула вуглекислого газу – це продукти. Схема реації є тільки її якісною характеристикою. Кількісну характеристику реакції відображає закон збереження маси речовини. Відповідно до цього закону число атомів різних елементів під час хімічної реакції не змінюється. Число атомів одного елемента до реакції і після мають дорівнювати. Це має бути відображено в схемі хімічної реакції, тоді вона стає хімічним рівнянням. Число атомів урівнюють за допомогою коефіцієнтів.
Рівняння хімічної реакції – це умовний запис хімічних перетворень за допомогою формул та коефіцієнтів.
До цього вдавалися ще за часів середньовіччя. Однак тоді алхіміки приховували свої знання й зашифровували записи. Зараз рівняння реакцій записують, ґрунтуючись на загальноприйнятих положеннях, і прочитати їх може будь-яка людина, знайома з основами хімії.
Якщо сказати, що символи хімічних елементів — це літери хімічної мови, то формули сполук — це слова, а рівняння реакцій — цілі фрази.
Так, фразу «Водень взаємодіє з киснем з утворенням води» за допомогою хімічних формул можна записати в такий спосіб:
Н2+ О2 —>Н2О
Треба відзначити, що, по-перше, число атомів кожного хімічного елемента в лівій і правій частинах рівняння є однаковим; по-друге маса речовин, що вступили в реакцію, дорівнює масі речовин, що утворилися в результаті реакції.
Для того щоб складене нами рівняння не суперечило закону збереження маси, необхідно зрівняти кількість атомів усіх елементів обох частинах. Для цього слід поставити відповідні коефіцієнти
2Н2 + О2 = 2Н2О
Рівність числа атомів у лівій частині й числа атомів у правій частині, а також зумовлена цим рівність мас речовин є доказом правильності розміщення коефіцієнтів.
Відносна атомна маса — це безрозмірна величина, що дорівнює відношенню маси атома до 1/12 маси атома Карбону.
(Дивись Періодичну систему хімічних елементів Д. І. Менделєєва.)
Ar (O)= 16
Ar(H) = 1
Ar( S) = 32
Відносна молекулярна маса — це величина, що дорівнює відношенню маси молекули до 1/12 маси атома Карбону.
Mr (H2SO4) = 2· Ar (H) + Ar( S) +4· Ar (O) = 2·1 + 32 +4·16 = 98
Масова частка елемента — це величина, що показує, яка частка маси речовини або молекули припадає на атоми даного елемента.
Завдання до заняття №1
1. Закінчіть рівняння реакції:
KMnO4→
P + O2→
C + O2→
Al + O2→
CH4 +O2→
2 Обчисліть відносну молекулярну масу Ca(OH)
3. Обчисліть відносну молекулярну масуNa2CO3.
4. Обчисліть відносну молекулярну масуFe(OH)2.
5. Обчисліть масову частку Оксигену уNa2CO3.
6. Обчисліть масову частку Оксигену уFe(OH)2.
Тест самоконтролю до заняття №1
Виберіть одну правильну відповідь питання №1-7.
- Вкажіть назву явища, що відбувається з зміною агрегатного стану та форми речовини:
А географічне;
Б біологічне;
В хімічне;
Г фізичне
- Вкажіть назву числа перед формулою, що показує кількість частинок:
А індекс;
Б валентність;
В заряд;
Г коефіцієнт
- Вкажіть назву найменшої частинки речовини, що зберігає її хімічні властивості:
А атом;
Б йон;
В молекула;
Г катіон
- Вкажіть частинки, що входять до складу складних речовин:
А молекули різних елементів;
В сукупність катіонів;
Б атоми різних елементів;
Г молекули речовин
- Вкажіть відносну молекулярну масу кисню:
А 16;
Б 8;
В 32;
Г 15
- Вкажіть схему обчислення відносної молекулярної маси Fe3O4:
А 56 + 16;
Б 3 + 55 + 4 + 16;
В 3 · 56 + 4 · 16;
Г 56 · 3 + 16
- Вкажіть значення коефіцієнтів у рівнянні К + О2 > К2О:
А 2,1,1;
Б 1, 1,2;
В 4,1,2;
Г 4, 2,2
Виберіть дві правильні відповіді № 8-9
- Виберіть з переліку елементи-неметали:
А Li;
Б P;
В Fe;
Г As;
- Виберіть формули сполук у яких атоми металів мають валентність II:
А СaF2;
Б MnO2;
В CO;
Г Zn3P2
Виконайте завдання № 10-12
- Закінчіть рівняння реакції:
А H2O2→
Б Zn + O2→
- Обчисліть відносну молекулярну масу Ca(OH)2.
- Встановіть відповідність між поширенням у природі і хімічним елементом:
Поширення у природі Хімічний елемент
 1 найпоширеніший елемент космосу; А N;
1 найпоширеніший елемент космосу; А N;
2 найпоширеніший у земній корі; Б H;
3 найпоширеніший в атмосфері Землі; В O;
Г Al
Критерії оцінювання до тесту для самоконтролю заняття №1
- завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань — 3 бали;
- завдання 7–9 оцінюються по 1балу, разом за дев’ять правильно виконаних завдань — 6 балів;
- завдання10-12оцінюються по 2 бали, разом за всі правильно виконаних завдань — 12балів
Відповіді до тесту самоконтролю заняття №1
|
№ питання |
Відповідь |
Кількість балів |
|
1 |
Г |
0.5 |
|
2 |
Г |
0.5 |
|
3 |
В |
0.5 |
|
4 |
Б |
0.5 |
|
5 |
В |
0.5 |
|
6 |
В |
0.5 |
|
7 |
В |
1 |
|
8 |
Б, Г |
1 |
|
9 |
А, Г |
1 |
|
10 |
2Н2О2 = 2Н2О + О2 |
2 |
|
11 |
Mr (Ca(OH)2)= 40 + 2(16 + 1) = 74 |
2 |
|
12 |
1- Б; 2- В; 3- А |
2 |
Заняття №2 «Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро»
Тема: Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро.
Цілі: сформувати уявлення учнів про хімічне поняття «кількість речовини»; ознайомити з одиницею вимірювання кількості речовини, увести поняття «моль», «стала Авогадро»; формувати вміння застосовувати набуті знання під час розв’язування розрахункових задач, розвивати вміння робити висновки, виділяти головне, розвивати абстрактне й образне мислення.розвивати їхню самостійність; виховувати творчу, допитливу особистість.
Інструкція до заняття №2
Для успішного вивчення теми заняття №2«Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро.» необхідно:
1.Вивчити теоретичний матеріал.
2. Переглянути презентацію «Кількість речовини.».
3. Зробити опорний конспект
4. Вивчити основні поняття.
5. Виконати практичне завдання
6. Відповісти на питання тесту для самоконтролю «Кількість речовини.»
Теоретичний матеріал до заняття №2
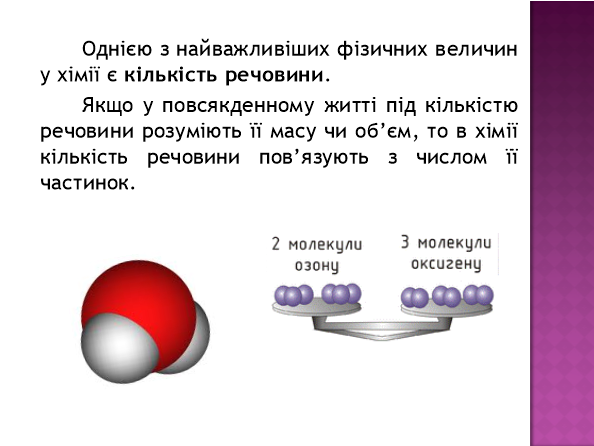
Відомо, що для вивчення навколишнього світу недостатньо лише спостерігати й описувати об'єкти. Важливо ще характеризувати їх кількісно, тобто якимись величинами. Порцію води, наприклад, можна характеризувати кількісно, вимірявши її об'єм у літрах або масу в грамах. Але для хіміка поряд з цим важливо ще знати число структурних частинок (атомів, молекул або йонів), які містяться в цій порції речовини, оскільки саме вони вступатимуть у хімічну взаємодію. Ось чому в хімії і суміжних з нею науках використовують фізичну величину — кількість речовини.
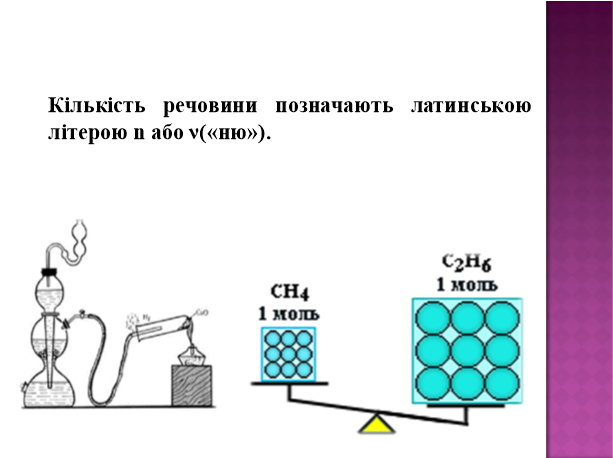
Кількість речовин — це фізична величина, що визначається числом структурних частинок (атомів, молекул, йонів тощо), які містяться в даній порції речовини.Вона позначається латинською літерою n (ен) або грецькою v (ню).
Атоми і молекули, з яких складається речовина, дуже малі, їхнє число в оточуючому нас світі величезне. Навіть у самому маленькому кристалі цукру число молекул перевищує мільярд мільярдів. Тому досить незручно перелічити окремі молекули. Для вимірювання кількості речовини використовують спеціальну одиницю — моль.
Назва одиниці вимірювання кількості речовини походить від латинського слова «moles», що в перекладі означає «кількість, безліч».Одиниця кількості речовини, яка в 1000 разів більша за моль, називається кіломоль — кмоль (1 кмоль містить 1000 моль), а одиниця кількості речовини, яка в 1000 разів менша за моль, називається мілімоль — ммоль (1 моль містить 1000 ммоль).
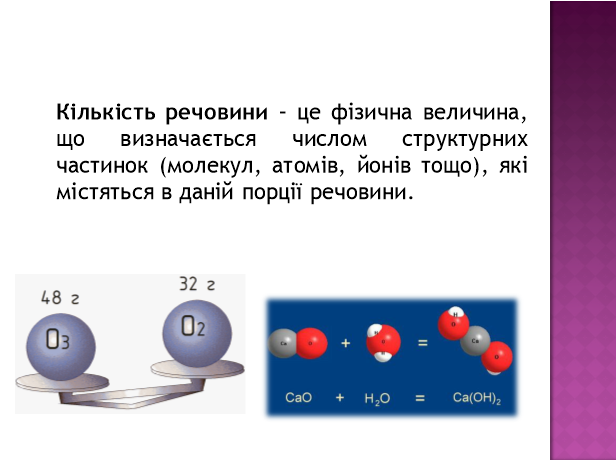
Моль — це така кількість речовини, яка містить стільки частинок (атомів, молекул, йонів та ін.), скільки міститься атомів у Карбоні масою 0,012 кг.
Отже, маса 1 моль вуглецю дорівнює 12 г. А скільки у цій порції вуглецю кількістю речовини 1 моль міститься атомів Карбону?
Експериментально доведено, що 1 моль речовини містить 6,02•1023 частинок (атомів, молекул, йонів та ін.). Це число на честь італійського вченого називається числом Авогадро. Зазвичай число Авогадро позначають латинською літерою N з індексом А, тобто NA.При написанні слово «моль» відмінюється, коли перед ним не стоїть число, і не відмінюється після числа або змінної. Наприклад: два .моля водню реагує з одним молем кисню, але 2 моль водню реагує з 1 моль кисню. До цієї величини слід відноситися як до звичайного числа, що означає певну порцію речовини. У тому, що моль означає таке екзотичне число, не має нічого незвичайного. З такими числами (або порціями) ми зустрічаємося досить часто і використовуємо їх для вимірювання маси, об'єму, часу і навіть грошей. Більшість з них є досить простими числами. Наприклад, одна тонна — це одна тисяча кілограмів, один кубічний метр — це одна тисяча літрів, одна година — це 60 хвилин, одна гривня — це сто копійок. Але іноді такі величини є не дуже звичними і не завжди кратні десяти: одна доба — це 24 години, одна дюжина — це 12 штук, один карат — це 0,4 грама, а один світовий рік — це майже 9,5-1012 кілометрів. (див. Таблицю №1)
|
Фізична величина |
Символ яким позначається |
Найменування |
Значення |
|
Час |
t |
год |
3600 с |
|
Довжина |
l |
м |
100 см |
|
Маса |
m |
кг |
1000 г |
|
Кількість речовини |
n |
моль |
6,02•1023 частинок |
Мал. 2. АмадеоАвогадро.
АМЕДЕО АВОГАДРО (1776—1856)
Італійський фізик і хімік. Заклав основи молекулярної теорії, відкрив один із газових законів, названий його ім'ям. Визначив склад і відносну молекулярну масу багатьох речовин. Довів, що молекули водню, кисню, азоту, хлору двоатомні. Його праці сприяли подальшому розвитку атомно-молекулярної теорії.
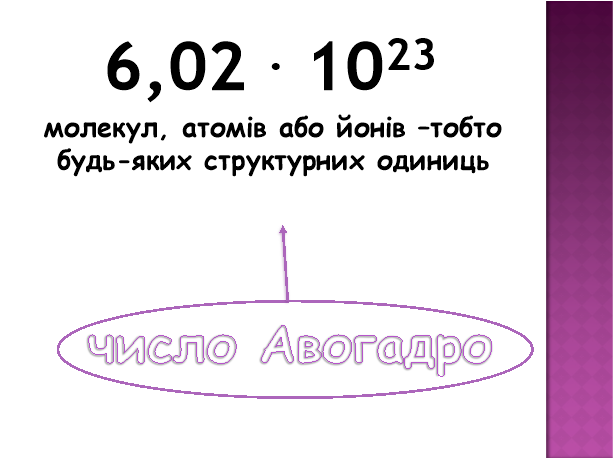
Число Авогадро- 6,02•1023 показує число частинок, які містяться в 1 моль будь-якої речовини незалежно від її агрегатного стану, а фізико-хімічна константа, що відповідає цьому числу, називається сталою Авогадро, позначається також NA. Якщо 1 моль речовини містить 6,02•1023 частинок, то: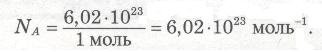
Це настільки велике число, що через силу піддасться уяві. Проте спробуємо показати всю грандіозність цього числа.
Якби ми спромоглися виміряти всю воду Світового океану склянками, то дістали б майже 7•1014 склянок. Хоча це число саме по собі величезне, але воно становить лише одну мільярдну частину сталої Авогадро!
Інший приклад. Число макових зерняток, що дорівнює 6,02•1023, має масу 1013 т. Цією масою макових зерняток можна було б покрити всю поверхню Землі шаром в 1 м. Іще приклад. Пустеля Сахара містить менше трьох моль найдрібніших піщинок. Отже, 1 моль будь-якої речовини містить NA частинок, тобто 6,02•1023. Наприклад, 1 моль міді — це 6,02•1023 атомів КупрумуCu; 1 моль кисню — 6,02•1023 молекул 02 або 12,04•1023 атомів Оксигену; 1 моль кухонної солі NaCl — 6,02•1023 формульних одиниць NaCl.
Практичне застосування щодо реалізації набутих теоретичних знань.
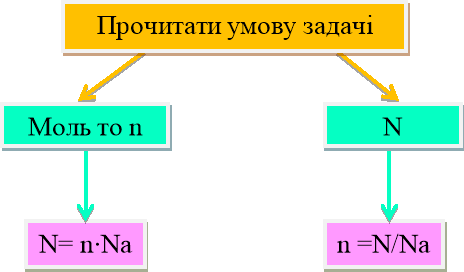
Розглянемо приклади розрахунків із використанням сталої Авогадро використовуючи алгоритм:
Задача 1.Обчисліть кількість речовини магнію ,що містить 24,08 · 1023 атомів.
![]() Дано:
Дано:
N(Mg)=24,08 · 1023 n=N/Na
![]() Na = 6.02·1023моль-1
Na = 6.02·1023моль-1
n(Mg)- ? n (Mg) =24,08 · 1023/6.02·1023 моль- 1= 4 моль
Відповідь.4 моль магнію містить 24,08 · 1023 атомів.
Задача 2. Яке число молекул містить вуглекислий газ кількістю речовини 1.5 моль?
![]() Дано:
Дано:
n(CO2)=1,5 моль n=N/Na
![]() N= n·Na
N= n·Na
N(CO2)- ? Na = 6.02·1023моль-1
N(CO2)=1,5 моль·6.02·1023 моль -1= 9.03·1023
Відповідь. У вуглекислому газі кількістю речовини 1.5 моль міститься 9.03·1023 молекул СО2.
Задача 3.Скільки атомів і скільки молекул міститься у хлорі кількістю речовини 3 моль?
![]() Дано:
Дано:
n(Cl2)=3 моль n=N/Na
![]() N= n·Na
N= n·Na
N (Cl2)- ? N(Cl)-? Na = 6.02·1023моль-1
N(Cl2) = 3 моль![]() 6,02·1023 моль-1 = 1,06·1023 молекул. Оскільки кожна молекула хлору Cl2 містить два атоми, то атомів Хлору в З моль Cl2 буде вдвічі більше, ніж молекул, тобто N (Cl) =18,06·1023 ·2 = 36,12·1023 атомів.
6,02·1023 моль-1 = 1,06·1023 молекул. Оскільки кожна молекула хлору Cl2 містить два атоми, то атомів Хлору в З моль Cl2 буде вдвічі більше, ніж молекул, тобто N (Cl) =18,06·1023 ·2 = 36,12·1023 атомів.
Відповідь. У хлорі кількістю речовини 3 моль міститься 18,06·1023 молекул Cl2 і 36,12·1023 атомів СІ.
Завдання до заняття №2
- Обчисліть кількість речовини цинку,що містить 30,1 · 1023 атомів.
- Скільки атомів Гідрогену й Оксигену міститься у воді Н20 кількістю речовини 1 моль ?
- Скільки атомів містить: а) мідь кількістю речовини 3 моль; б) залізо кількістю речовини 0,5 моль?
- Скільки молекул і атомів містить азот N2 кількістю речовини 2 моль?
- Яку кількість речовини становить: а) З•1023 атомів Сульфуру; б) 18•1023 молекул брому Вr2?
Тест самоконтролю до заняття №2
Виберіть одну правильну відповідь питання №1-9.
1.Вкажіть символ, яким позначається числоАвогадро:
А Nа;
Б Vm;
В N;
Г n
2. Одиниця вимірювання кількості речовини:
А л;
Б моль;
В кг;
Г с
3. Вкажіть формулу за якою знаходять число молекул:
АV = m/M;
Б M = m / ν;
В N = n·Na;
Г V = Vm·ν
4.Вкажітьзначення числа Авогадро:
А 3,02;
Б 5·1023г/моль;
В 6,02 · 1023моль-1;
Г 22,4моль/л
5.Визначте число молекул, що відповідає 0,5 моль водню:
А 24,02·1023;
Б 6,02·1023;
В 3,01·1023;
Г 12,04 ·1023
6.Визначтекількістьречовини, що містить 12,04 · 1023 молекул хлору:
А 1моль;
Б 0,5моль;
В 2моль
Г 4моль
7. Визначте кількість речовини, що містить 3,01 · 1023 молекул кисню:
А 1моль;
Б 0,5моль;
В 2моль
Г 4моль
8. Обчисліть кількість молекул в 10 моль кисню.
А 60,2 молекул;
Б 5·1023 молекул;
В 6,02 · 1023 молекул;
Г 22,4 молекул
9. У водні кількістю речовини 1,5 моль міститься:
А 4. 52·1023 2молекул;
Б 3,01·1023 молекул;
В 12,04·1023 молекул;
Г 9,03·1023 молекул.
Виконайте завдання.
10.Встановітьвідповідністьміж величиною та їх значенням: Фізична величина Значення
 1 числоАвогадро; А 22,4л/моль;
1 числоАвогадро; А 22,4л/моль;
2 об’ємгазів; Б 6,02 ·1023моль-3 відноснаатомна масаСульфура; В 2,24л/моль;
Г 32
11. Встановіть відповідність між кількістю молекул та кількістю речовини:
Кількість молекул Кількість речовини
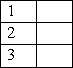 1 3,01·1023 молекул H2O; А 0,5моль;
1 3,01·1023 молекул H2O; А 0,5моль;
2 9,03·1023 молекул СO2; Б 1моль;
3 1,2·1023 молекул Н2; В 1,5моль;
Г 0,2 моль
12. Кількість речовини — це...
Критерії оцінювання до тесту для самоконтролю заняття №2
- завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань — 3 бали;
- завдання 7–9 оцінюються по 1балу, разом за дев’ять правильно виконаних завдань — 6балів;
- завдання 10-12оцінюються по 2 бали, разом за всі правильно виконаних завдань — 12 балів.
Відповіді до тесту самоконтролю заняття № 2
|
№ питання |
Відповідь |
Кількість балів |
|
1 |
А |
0.5 |
|
2 |
Б |
0.5 |
|
3 |
В |
0.5 |
|
4 |
В |
0.5 |
|
5 |
В |
0.5 |
|
6 |
В |
0.5 |
|
7 |
Б |
1 |
|
8 |
А |
1 |
|
9 |
Г |
1 |
|
10 |
1- Б; 2- А; 3- Г |
2 |
|
11 |
1- Б; 2- В; 3- А |
2 |
|
12 |
Кількість речовин — це фізична величина, що визначається числом структурних частинок (атомів, молекул, йонів тощо), які містяться в даній порції речовини. |
2 |
Презентація до заняття №2.



Заняття №3 «Молярна маса.»
Тема: Молярна маса. Обчислення за хімічною формулою молярної маси, маси і кількості речовини.
Цілі: сформувати уявлення учнів про хімічне поняття «молярна маса речовини»; порівняти кількісні значення молярної маси та відносної атомної та молекулярної маси речовини; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв’язок між кількістю речовини, формувати вміння застосовувати набуті знання під час розв’язування розрахункових задач, розвивати вміння робити висновки, виділяти головне, розвивати абстрактне й образне мислення; виховувати творчу, допитливу особистість.
Інструкція до заняття №3
Для успішного вивчення теми заняття №3 «Молярна маса. Обчислення за хімічною формулою молярної маси, маси і кількості речовини.» необхідно:
1.Вивчити теоретичний матеріал.
2. Переглянути презентацію «Молярна маса»
4. Вивчити основні поняття.
5. Виконати практичне завдання
6. Відповісти на питання тесту для самоконтролю «Молярна маса.»
Теоретичний матеріал до заняття №3
Кількість речовини один моль, тобто порція, яка обов’язково містить 6,02·1023частинок, має масу, характерну саме для цієї речовини. Наприклад, один моль заліза Fe відповідає масі 56 г, один моль води H2O - масі 18 г. Таку характеристику речовини — масу одного моль даної речовини — називають молярною масою та позначають M.
Молярна маса речовини чисельно дорівнює відносній атомній масі, якщо речовина складається з атомів, або відносній молекулярній масі, якщо речовина складається з молекул. Це чисельне співпадіння пояснюється тим, що в одному грамі міститься 6,02·1023 атомних одиниць маси, в яких виражаються відносні атомні та молекулярні маси.
Оскільки молярна маса показує масу одного моля, вона має розмірність г/моль. Таким чином, розрахувати молярну масу можна аналогічно до розрахунку відносної молекулярної маси речовини, що визначається як сума відносних атомних мас елементів, що входять до складу речовини, з урахуванням їхньої кількості. Але треба пам’ятати, що відносна атомна та відносна молекулярна маси є безрозмірними величинами, а молярна маса виражається в г/моль.
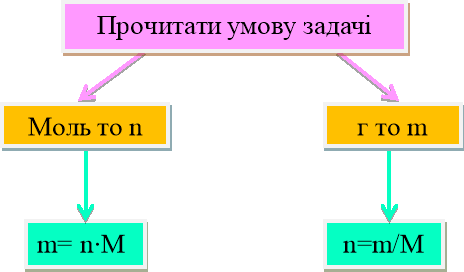
Молярна маса речовини — це відношення маси даної порції речовини до кількості речовини в цій порції:
M = m/n
За допомогою цієї формули можна визначити кількість речовини, якщо відома маса речовини, та навпаки.
Наприклад, визначимо масу 3 моль вуглекислого газу CO2. Спочатку визначаємо молярну масу CO2:
Mr (CO2) = Ar(C) + 2 · Ar(O) = 12 + 2 · 16 = 44
M (CO2) = 44 г/моль
Масу речовини визначаємо за формулою:
m = n · M
Маса вуглекислого газу дорівнює:
m(CO2) = 3 моль · 44 г/моль = 132 г.
Тепер визначимо кількість речовини амоніаку NH3 масою 3,4 г. Визначаємо молярну масу NH3:
M (NH3) = Ar(N) + 3 · Ar(H) = 14 + 3 · 1 = 17 г/моль
Кількість речовини визначаємо за формулою:
n = m/M
Кількість речовини амоніаку дорівнює:
n(NH3) = 3,4 г/17 г/моль= 0.2 моль
Одиниця молярної маси — кілограм на моль (кг/моль) або грам на моль (г/моль). Виходить, що маса 1 моль речовини і є її молярною масою. Вона виражає залежність між масою і кількістю речовини, а тому дає змогу визначати одну величину за відомою іншою. Наприклад: масу за кількістю речовини і навпаки, кількість речовини за масою.
 Практичне застосування щодо реалізації набутих теоретичних знань.
Практичне застосування щодо реалізації набутих теоретичних знань.
Задача 1.Яка маса відповідає магній оксиду MgO кількістю речовини 6 моль?
![]() Дано:
Дано:
n (MgO)=6 моль m = n·M
![]() Mr (MgO) = Ar(Mg) + Ar (O) =24 + 16 =40
Mr (MgO) = Ar(Mg) + Ar (O) =24 + 16 =40
m(MgО)- ? M (MgO) = 40 г/моль
m (MgO) = 6 моль· 40 г/ моль=240 г
Відповідь. 240 г магній оксиду MgO
Задача 2.Обчисліть кількість речовини хлору(Cl2) масою 14,2 г.
![]() Дано:
Дано:
m(Cl2)=14,2 г n=m/M
![]() Mr (Cl2) =2·Ar (Cl) =2·35,5 =71
Mr (Cl2) =2·Ar (Cl) =2·35,5 =71
n(Cl2)- ? M(Cl2) =71г/моль
n(Cl2) =14.2 г/71 г/моль = 0.2 моль
Відповідь. 0.2 моль хлору.
Задача 3.Обчисліть кількість води масою 1кг.
![]() Дано:
Дано:
m(H2O)=1 кг =1000 г n=m/M
![]() Mr(Н2О) = 2·Аr(H) + Ar (O) =2·1 + 16 = 18
Mr(Н2О) = 2·Аr(H) + Ar (O) =2·1 + 16 = 18
n(H2O) =? M(Н2О) = 18 г/моль
n(Н2О) = 1000 г/18 г/моль = 55.6 моль
Відповідь. 55.6 моль води.
Завдання до заняття №3
1. Обчисліть кількість речовини магнію масою 60 г.
2. Обчисліть кількість речовини хлору(Cl2) масою88.75 г.
3. Обчисліть кількість речовини алюмінію масою 81 г.
4. Обчисліть масу Na2S кількістю речовини 2,5 моль.
5. Обчисліть масу К2S кількістю речовини 1,2 моль.
6. Обчисліть масу Li3P кількістю речовини 1,4 моль.
Тест самоконтролю до заняття №3
Виберіть одну правильну відповідь питання №1-7
1.Вкажіть символ, яким позначається молярна маса:
А Nа;
Б Vm;
В N;
Г М
2. Вкажіть що позначає молярна маса:
А масса однієї молекули у грамах;
Б маса одного атома у грамах;
В маса одного моля у грамах;
Г масса речовини
3. Вкажіть одиницю вимірювання молярної маси речовини:
А л/моль;
Б г/моль;
В моль/кг;
Г г/мл
4. Вкажіть формулу за якою знаходять массу речовини:
А V = m ·Vm/M;
Б M = m∕ν;
В m = M·ν;
Г V = Vm·ν
5. Вкажіть значення молярної маси кисню :
А 12 г/моль;
Б 2 г/моль;
В 98 г/моль;
Г 32 г/моль
6. Вкажіть значення молярної маси водню :
А 12 г/моль;
Б 2 г/моль;
В 98 г/моль;
Г 32 г/моль6.
7. Вкажіть значення молярної маси сульфатної кислоти :
А 12 г/моль;
Б 2 г/моль;
В 98 г/моль;
Г 32 г/моль
8. Відносна молекулярна масса нітроген (II) оксиду дорівнює:
А44;
Б 60;
В 46;
Г 30
9. Відносна молекулярна масса сульфур (IV) оксиду дорівнює:
А 48;
Б 64;
В 96;
Г 80
Виконайте завдання.
10. Установіть послідовність зростання молярних мас речовин:
 А сульфур (IV) оксид;
А сульфур (IV) оксид;
Б амоніак (NH3);
В гідроген пероксид (H2O2);
Г карбон (ІІ) оксид;
11.Установіть послідовність зменшення молярних мас речовин:
 А карбон (ІІ) оксид;
А карбон (ІІ) оксид;
Б вода;
В повітря;
Г кисень;
12.Встановіть відповідність між масою та кількістю речовини:
Маса речовини Кількість речовини
 118гH2O; А 0,5моль;
118гH2O; А 0,5моль;
2 22г СO2; Б 1моль;
3 3,6гН2О; В 1,2моль;
Г 0,2 моль
Критерії оцінювання до тесту для самоконтролю заняття №3
- завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань — 3 бали;
- завдання 7–9 оцінюються по 1балу, разом за дев’ять правильно виконаних завдань — 6балів;
- завдання 10-12оцінюються по 2 бали, разом за всі правильно виконаних завдань — 12 балів.
Відповіді до тесту самоконтролю заняття №3
|
№ питання |
Відповідь |
Кількість балів |
|
1 |
Г |
0.5 |
|
2 |
Б |
0.5 |
|
3 |
Б |
0.5 |
|
4 |
В |
0.5 |
|
5 |
Г |
0.5 |
|
6 |
Б |
0.5 |
|
7 |
В |
1 |
|
8 |
Г |
1 |
|
9 |
Б |
1 |
|
10 |
1-Б, 2-Г, 3-В, 4-А |
2 |
|
11 |
1-Г, 2-В, 3-А,4-Б, |
2 |
|
12 |
1- Б; 2- А; 3- Г |
2 |
Презентація до заняття № 3.





Заняття №4 «Обчислення за хімічною формулою маси даної кількості речовини і кількості речовини за відомою масою»
Тема: Обчислення за хімічною формулою молярної маси, маси і кількості речовини.
Цілі: продовжувати формувати уявлення учнів про хімічне поняття «молярна маса речовини»; порівнювати кількісні значення молярної маси та відносної атомної та молекулярної маси речовини;, формувати вміння застосовувати набуті знання під час розв’язування розрахункових задач, розвивати вміння робити висновки, виділяти головне, розвивати абстрактне й образне мислення;розвивати їхню самостійність в опануванні знань; виховувати творчу, допитливу особистість
Інструкція до заняття №4
Для успішного вивчення теми заняття №4 «Обчислення за хімічною формулою молярної маси, маси і кількості речовини.» необхідно:
1.Повторити теоретичний матеріал занять № 1-3.
2. Переглянути презентацію « Основні поняття хімії», «Кількість речовини» та «молярна маса».
3. Зробити опорний конспект.
4. Виконати практичне завдання
Теоретичний матеріал до заняття №4
Повтори теоретичний матеріал заняття № 1-3 та виконай завдання:
1. Обчислитимасу речовини за формулою m = n·M
2. Обчислити число молекул складної речовини за формулою N = n·NA.
3. За хімічною формулою речовини визначити число атомів кожного елемента в молекулі складної речовини.
4. Обчислитикількістьатомівхімічногоелементавзаданійкількостіречовини.
|
речовини |
Кількість речовини |
Маса речовини |
Число молекул |
Число атомів |
||
|
K2SO4 |
0,5 моль |
|
|
K |
S |
O |
|
|
|
|
|
|||
|
NaNO3 |
1,5 моль |
|
|
Na |
N |
O |
|
|
|
|
|
|||
|
Ca(OH)2 |
0,8 моль |
|
|
Ca |
O |
H |
|
|
|
|
|
|||
|
H3PO4 |
2 моль |
|
|
H |
P |
O |
|
|
|
|
|
|||
 Практичне застосування щодо реалізації набутих теоретичних знань.
Практичне застосування щодо реалізації набутих теоретичних знань.
Задача 1.Обчисліть кількість речовини та кількість атомів калію масою 68.25 г.
![]() Дано:
Дано:
M(К)= 68.25 г n =m/MN = n·Na
![]() n(K) = 68.25 г/39 г/моль= 1.75 моль
n(K) = 68.25 г/39 г/моль= 1.75 моль
n= (K)- ? Mr(К) = Ar(К) =39
N= (K)- ? M(К)= 39г/моль
N (K) = 1.75моль·6.02·1023моль-1= 10.5·1023
Відповідь.1.75 моль кількість речовини та10.5·1023 кількість атомівкалію
Задача 2.Яка маса відповідає 10.54·1023 молекул сульфур (VI) оксидуSO3?
![]() Дано:
Дано:
N (SO3)=10.54·1023 n = N/Nam = n·M
![]() n(SO3) = 10.54·1023/ 6.02·1023моль-1= 1.75 моль
n(SO3) = 10.54·1023/ 6.02·1023моль-1= 1.75 моль
m (SO3)- ? Mr (SO3) = Ar(S) + Ar (O) =32 +3· 16 =80
M(SO3 )= 80г/моль
m (SO3) = 1.75моль· 80 г/ моль=140 г
Відповідь. 140 г маса сульфур (VI) оксидуSO3.
Задача 3.Яка маса відповідає 1.5·1023 молекул карбон (ІV) оксидуСO2?
![]() Дано:
Дано:
N (СO2)=1.5·1023 n = N/Nam = n·M
![]() n(СO2) = 1.5·1023 / 6.02·1023моль-1= 0.25 моль
n(СO2) = 1.5·1023 / 6.02·1023моль-1= 0.25 моль
m (СO2)- ? Mr(СO2) = Ar(С) +2·Ar (O) = 12 +2· 16 =44
M(СO2 )= 44г/моль
m (СO2) = 0.25моль· 44 г/ моль=11 г
Відповідь. 11 г маса карбон (ІV) оксидуСO2.
Завдання до заняття №4
1. Обчисліть кількість речовини та кількість атомівцинкумасою130 г.
2. Обчисліть кількість речовини та кількість молекул хлору (Cl2) масою124.25 г.
3. Обчисліть кількість речовини та кількість атомів натрію масою 34.5 г.
4. Обчисліть масу 4.5·1023 молекул води.
5Обчисліть масу 21.07·1023 молекул Н2S
6. Обчисліть масу 15.05·1023 молекул С6Н12О6.
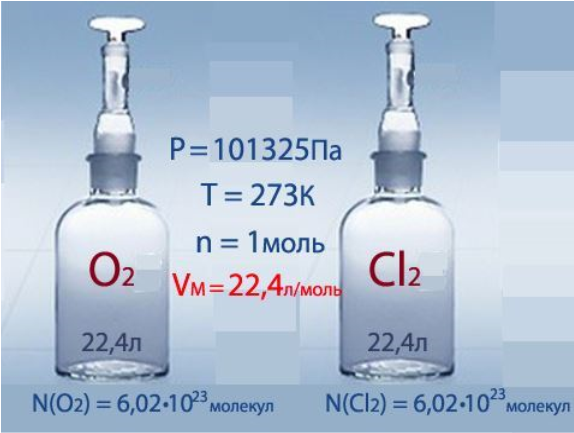
Заняття №5 «Молярний об’єм газів. Закон Авогадро.»
Тема :Молярний об’єм газів. Закон Авогадро. Обчислення об'єму газів за нормальних умов.
Цілі : сформувати уявлення учнів про закон Авогадро; ознайомити учнів з поняттям «молярний об’єм» газу та встановити взаємозв’язок між кількістю речовини та об’ємом, об’ємом та масою газу; розкрити особливості використання поняття «молярний об’єм» для газоподібних речовин; навчити учнів використовувати отримані знання для розрахунків об’ємів газів за нормальних умов;сприяти активізації пізнавальної діяльності учнів, розвивати їхню самостійність в опануванні знань; виховувати творчу, допитливу особистість.
Інструкція до заняття №5
Для успішного вивчення теми заняття №5 «Молярний об’єм газів. Закон Авогадро. Обчислення об'єму газів за нормальних умов.» необхідно:
1.Вивчити теоретичний матеріал.
2. Переглянути презентацію «Молярний об’єм газів. Закон Авогадро.».
3. Зробити опорний конспект.
4. Вивчити основні поняття.
5. Виконати практичне завдання
6. Відповісти на питання тесту для самоконтролю «Молярний об’єм газів. Закон Авогадро.».
Теоретичний матеріал до заняття №5
На попередніх заняттях ми навчилися знаходити кількість речовини, кількість структурних частинок в певній кількості речовини, переходити від кількості речовини до маси, адже нам легше відважити певну масу речовини, ніж порахувати певну кількість структурних частинок. Але, зважити газоподібну речовину дуже важко. Для вимірювання газів краще використовувати об’єми. Тому, на сьогоднішньому занятті нам необхідно з’ясувати, як пов’язані між собою кількість речовини і об’єм.
Вивченням газоподібних речовин займалися багато вчених: французький хімік Гей-Люссак, англійський фізик Роберт Бойль. Вони довели, що всі гази однаково стискуються, мають однаковий температурний коефіцієнт розширення, і щo об’єми газів залежать не від розмірів частинок, а від відстані між ними. При незмінних умовах (температурі та тиску) відстані між молекулами різних газів приблизно одинакові. На підставі цих законів і своїх досліджень італійський учений Амедео Авогадро сформулював закон: В однакових об’ємах різних газів міститься однакова кількість молекул. На основі цього закону справедливим буде обернене твердження: Однакова кількість молекул різних газів за однакових умов займатиме однаковий об’єм. Давайте обчислимо об’єм, що займатиме 1моль або 6,02×1023 молекул різних газів. З курсу фізики відомо, що існує залежність між об’ємом та масою через густину: m=V∙ρ; звідси: V= m/ρ.
Для 1 моля речовини m = М, отже формулу для знаходження об’єму 1 моля газу можна записати так: V=M/ρ. Користуючись цією формулою , зробимо обчислення і заповнимо таблицю:
|
Газ |
n, моль |
М, г/моль |
Густина, г/л |
V, л |
|
Н2 |
1 |
2 |
0,089 |
22,4 |
|
О2 |
1 |
32 |
1,43 |
22,4 |
|
СО2 |
1 |
44 |
1,96 |
22,4 |
На основі ваших обчислень ми переконалися, що 1 моль будь-якого газу при незмінних умовах займатиме об’єм 22,4л.
Об’єм 1 моля газу називають молярним об’ємом і позначаютьVm.
Молярний об’єм – це фізична величина, що дорівнює відношенню об’єму газу до відповідної кількості речовини цього газу.
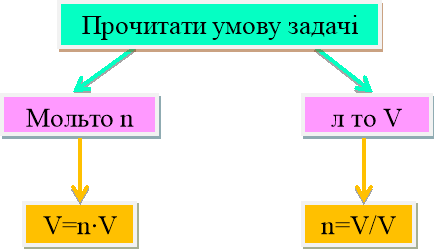
Vm= V/n;
[V]=л, [n]=моль, отже [Vm]= л/моль.
Значення молярного об’єму газів залежить від температури і тиску. У хімії прийнято відносити його до атмосферного тиску та температури 00 – такі умови називаються нормальними – t=0Cабо Т=2730К та Р=1атм. або 101,3 кПа.
Знаючи молярний об’єм газу, можна визначати кількість речовини, об’єм будь-якої кількості речовини та кількість структурних частинок в певному об’ємі газу.
З формули Vm=V/n → n=V/Vm
Практичне застосування щодо реалізації набутих теоретичних знань.
Розглянемо приклади розрахунків задач із використанням закону Авогадро використовуючи алгоритм:
Задача 1. Обчислити, якій кількості речовини відповідатиме 4,48 л вуглекислого газу.
Дано:
![]() V(CO2)=4,48л n=V/Vm
V(CO2)=4,48л n=V/Vm
![]() Vm=22,4л/моль
Vm=22,4л/моль
n-? n(CO2) =4,48 л/22,4л/моль=0,2моль
Відповідь. Кількість речовини СО20,2 моль
Задача 2. Обчислити об’єм, що займе при нормальних умовах водень кількістю речовини 1,5 моль. .
Дано:
![]() n(H2)=1,5 моль V=n·Vm
n(H2)=1,5 моль V=n·Vm
![]() V(H2)-? Vm= 22.4 л/моль
V(H2)-? Vm= 22.4 л/моль
V(H2)= 1,5 моль ·22,4 л/моль ·=33,6 л
Відповідь. Об'єм водню 33,6 л
Задача 3. Обчислити об’єм, що займе при нормальних умовах кисень кількістю речовини 7,5 моль.
![]() Дано:
Дано:
n(О2)=7,5 моль V=n·Vm
![]() Vm= 22,4 л/моль
Vm= 22,4 л/моль
V(О2)-? V(О2)=7,5 моль ·22,4 л/моль=168 л
Відповідь. Об'єм кисню 168 л
Завдання до заняття №5
1. Обчисліть кількість речовини HJ об’ємом 78,4 л.
2. Обчисліть кількість речовини HBr об’ємом 39,2 л.
3. Обчисліть кількість речовини HCl об’ємом 28 л.
4. Обчисліть кількість речовини H2S об’ємом 21,28 л.
5. Обчисліть кількість речовини HF об’ємом 89,6 л.
6. Обчисліть кількість речовини кисню (О2) об’ємом 15,68 л.
7. Обчисліть об’єм C2H2 кількістю речовини 3 моль.
8. Обчисліть об’єм N2О4 кількістю речовини 0,6 моль.
9. Обчисліть об’єм N2О кількістю речовини 6 моль.
10.Обчисліть об’єм HBr кількістю речовини 7 моль.
Тест самоконтролю до заняття №5
Виберіть одну правильну відповідь питання №1-8.
1.Вкажіть символ, яким позначається молярний об’єм газів:
А NA;
Б Vm;
В N;
Г υ
2. Вкажіть формулу за якою знаходять об’єм речовини:
АV = m ·Vm/M;
Б M = m∕n;
В Vm =V/n;
Г V = Vm·n
3. Вкажіть формулу за якою знаходять молярний об’єм речовини:
АV = m ·Vm/M;
Б M = m∕n;
В Vm =V/n;
Г V = Vm·n
4. Вкажіть що позначає молярний об’єм газів:
А об’єм однієї молекули у л;
Б об’єм одного атома у мл;
В об’єм одного моль газу у л;
Г об’єм газу
5. Вкажіть об’єм що займає однакове число молекул будь-яких газів за однакових умов:
А 11,2л
Б 22,4л;
В 0,5л;
Г 44,8л
6. Вкажіть об’єм 2 моль сульфур (IV) оксиду(SO2):
А 44,8л;
Б 22,4л;
В 44,800м3;
Г 10л
7. Вкажіть об’єм 3 моль метану(СН4):
А 22,4л;
Б 67,2л;
В 44,8л;
Г 44800мл
Виконайте завдання №8-12
8. Вкажіть об’єм 0,5 моль етану(С2Н6):
А 44,8л;
Б 11200мл
В 11,2л;
Г 22,4л
9.Встановітьвідповідністьміжоб’ємом та кількістю речовини:
Об’єм газів Кількість речовини
 1 22,4л; А 0,5моль;
1 22,4л; А 0,5моль;
2 11,2л; Б 2моль;
344,8л; В 1моль;
Г 5 моль
10. Встановіть відповідність між величиною та її значенням:
Фізична величина Значення
 1числоАвогадро; А 22,4л/моль;
1числоАвогадро; А 22,4л/моль;
2 Молярний об’єм газів; Б 6,02 ·1023моль-3 відносна молекулярна маса повітря; В 2,24л/моль;
Г 29
11.Встановітьвідповідністьміж величиною та її значенням: Фізична величина Значення
 1 відносна атомна маса Оксигену; А 22,4л/моль;
1 відносна атомна маса Оксигену; А 22,4л/моль;
2 молярний об’єм газів; Б 6,02 · 1023моль-1;
3 число Авогадро; В16;
Г 32
12.Встановітьвідповідністьміж величиною та її значенням:
Фізична величина Значення
 1відносна атомна маса Оксигену; А 22,4л/моль;
1відносна атомна маса Оксигену; А 22,4л/моль;
2 молярний об’єм газів; Б 6,02 · 1023моль-1;
3 число Авогадро; В16;
Критерії оцінювання до тесту для самоконтролю заняття №5
- завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань — 3 бали;
- завдання 7–9 оцінюються по 1балу, разом за дев’ять правильно виконаних завдань — 6 балів;
- завдання завдання10-12 оцінюються по 2 бали, разом за всі правильно виконаних завдань — 12 балів.
Відповіді до тесту самоконтролю заняття №5
|
№ питання |
Відповідь |
Кількість балів |
|
1 |
Б |
0.5 |
|
2 |
Г |
0.5 |
|
3 |
В |
0.5 |
|
4 |
В |
0.5 |
|
5 |
Б |
0.5 |
|
6 |
А |
0.5 |
|
7 |
Б |
1 |
|
8 |
В |
1 |
|
9 |
1-В; 2-А; 3-Б |
1 |
|
10 |
1-Б; 2-А; 3-Г |
2 |
|
11 |
1-Г; 2-А; 3-Б |
2 |
|
12 |
1-В; 2-А; 3-Б |
2 |
Презентація до заняття № 5.




Заняття №6 «Обчислення об’єму певної маси або кількості речовини відомого газу за нормальних умов.»
Тема: Обчислення об’єму певної маси або кількості речовини відомого газу за нормальних умов.
Цілі: продовжувати формувати уявлення учнів про хімічне поняття про закон Авогадро та встановити взаємозв’язок між кількістю речовини та об’ємом, об’ємом та масою газу; формувати вміння застосовувати набуті знання під час розв’язування розрахункових задач, розвивати вміння робити висновки, виділяти головне, розвивати абстрактне й образне мислення;розвивати їхню самостійність в опануванні знань; виховувати творчу, допитливу особистість
Інструкція до заняття №6
Для успішного вивчення теми заняття №6 «Обчислення об’єму певної маси або кількості речовини відомого газу за нормальних умов.» необхідно:
1.Повторити теоретичний матеріал занять № 2-5.
2. Переглянути презентації «Молярний об’єм газів. Закон Авогадро.» та «Молярна маса».
3. Зробити опорний конспект
4. Вивчити основні поняття.
5. Виконати практичне завдання
Теоретичний матеріал до заняття №6
Повтори теоретичний матеріал заняття № 1-3 та виконай завдання:
1. Обчислити кількість речовини за формулою n = N/Na
2. За хімічною формулою V = n·Vm визначити об’єм кожнї речовини.
3. Обчислити масу m = n·M хімічного елемента в заданій кількості речовини.
|
|
N |
n |
V |
m |
|
CO2 |
15,03 · 1023 молекул |
|
|
|
|
CoF2 |
42,14 · 1023 Атомів Co |
|
|
|
 Практичне застосування щодо реалізації набутих теоретичних знань.
Практичне застосування щодо реалізації набутих теоретичних знань.
Задача 1. Обчислити кількість молекул та атомів, що міститься в 89,6 л кисню при нормальних умовах.
![]() Дано:
Дано:
V(O2)=89,6л n =V/Vm
![]() n (O2)= 89,6 л / 22,4 л/моль= 4 моль
n (O2)= 89,6 л / 22,4 л/моль= 4 моль
Nмол.-?,Nатомів-? N = n·Na
Nмол.(О2)=4моль·6,02·1023 моль-1=24,08·1023
N атомів(О)=2· Nмол.(О2)=2·24,08·1023=48,16·1023
Відповідь. Nмол.(О2)=24,08·1023N атомів (О)=48,16·1023
.
Задача 2.За добу людина видихає 500л вуглекислого газу. Яка маса цього газу?
![]() V(СО2)=500л n = V/Vmm= n·M
V(СО2)=500л n = V/Vmm= n·M
![]()
m(СО2)-? n(СО2)= 500л/22,4 л/моль = 22.3 моль
M(СО2)=44 г/моль
m(СО2)=44 г/моль·22.3моль=981,2г
Відповідь. M(CO2)=981,2г
Задача 3 Балон містить 500г стисненого водню. Який об’єм займе ця маса водню за нормальних умов?
![]() m(H2)=500г n = m/MV = n·Vm
m(H2)=500г n = m/MV = n·Vm
![]() M(H2)=2 г/моль
M(H2)=2 г/моль
V(H2)-? n(H2) = 500г/2 г/моль = 250 моль
V(H2) =250 моль·22,4 л/моль=5600л
Відповідь.V(H2) =5600л
Завдання до заняття №6
1. Який об’єм сульфур (ІV) оксиду масою 12,8г?
2. Який об’єм карбон (ІV) оксиду масою33 г?
3. Якій масі відповідає карбон (ІV) оксид об’ємом 6, 72л?
4. Обчисліть масу та об’єм 12.04·1023 молекул водню.
5. Яка маса водню об’ємом 4,48л? Скільки молекул містить такий об’єм?
6. Обчисліть об’єм водню масою 8г. Яка кількість молекул там міститься? Якій кількості речовини це відповідає?
Заняття №7 «Відносна густина газів.»
Тема: Відносна густина газів. Обчислення відносної густини газів.
Цілі: розкрити суть поняття «відносна густина газів»; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків; сприяти активізації пізнавальної діяльності учнів, розвивати їхню самостійність в опануванні знань; виховувати творчу, допитливу особистість.
Інструкція до заняття №7
Для успішного вивчення теми заняття №7«Відносна густина газів. Обчислення відносної густини газів.» необхідно:
1.Вивчити теоретичний матеріал.
2. Переглянути презентацію «Відносна густина газів. Обчислення відносної густини газів.»
3. Зробити опорний конспект
4. Вивчити основні поняття.
5. Виконати практичне завдання
6. Відповісти на питання тесту для самоконтролю «Відносна густина газів. Обчислення відносної густини газів.»
Теоретичний матеріал до заняття №7
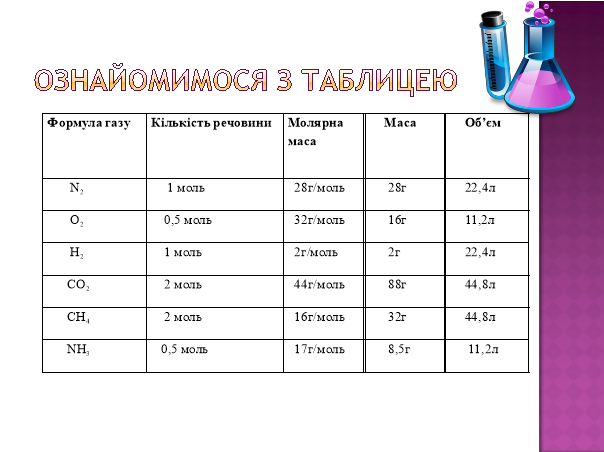
Ознайомимось з таблицею:
|
Кількість речовини |
Молярна маса |
Маса |
Об’єм |
|
|
N2 |
1 моль |
28 г/моль |
28 г |
22,4 л |
|
O2 |
0,5 моль |
32 г/моль |
16 г |
11,2 л |
|
H2 |
1 моль |
2 г/моль |
2 г |
22,4 л |
|
CO2 |
2 моль |
44 г/моль |
88 г |
44,8 л |
|
CH4 |
2 моль |
16 г/моль |
32 г |
44,8 л |
|
NH3 |
0,5 моль |
17 г/моль |
8,5 г |
11,2 л |
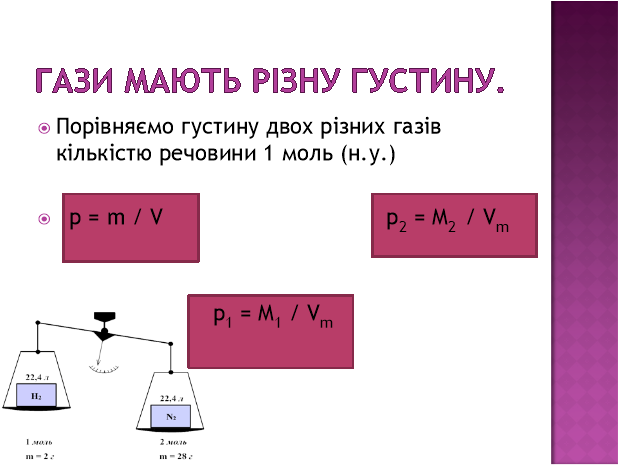
З таблиці на дошці видно, що однакова кількість речовини різних газів займає однаковий об’єм, але має різну масу, як і різну молярну масу. Тобто гази мають різну густину. Порівняємо густину двох газів кількістю речовини 1 моль за н. у.
![]() ;
;
![]() .
.
Тоді співвідношення густин:
![]() ρ.
ρ.
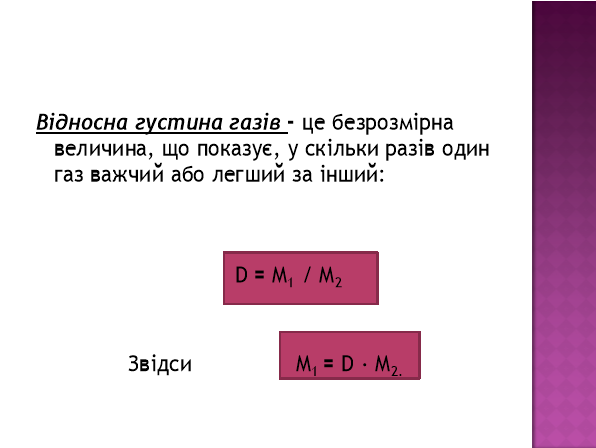
Таке співвідношення називають відносною густиною газів і позначають D. Це безрозмірна величина, що показує, у скільки разів один газ важчий або легший за інший.
![]() ,звідси
,звідси ![]() .
.
Отже, за молярною масою відомого газу можна визначити густину будь-якого газу.
Зазвичай густину газу визначають по відношенню до самого легкого газу водню. Позначають – DН2 = М1/М2, М2 = 2 г/моль, тоді
М1 = 2·DН2.
Часто густину газу визначають по відношенню до повітря. Повітря – це суміш газів, але найбільше в цій суміші азоту і кисню, тому враховуючи молекулярні маси цих газів розрахували середнє арифметичне, яке використовують для позначення молярної маси повітря: Мпов. = 29г/моль,
Тоді, М2 = 29·Dпов
Практичне застосування щодо реалізації набутих теоретичних знань
Задача 1. Обчислити відносну густину вуглекислого газу за воднем.
Дано:
![]() СО2 DH2 = M(CO2)/M (H2)
СО2 DH2 = M(CO2)/M (H2)
![]() DH2(CO2)-? Mr (H2) = 2·Ar (H) = 2·1 = 2
DH2(CO2)-? Mr (H2) = 2·Ar (H) = 2·1 = 2
M (H2) = 2 г/моль
Mr(СО2) =1·Ar (C) + 2·Ar (H) = 12 + 2·16 = 44
M (CO2) = 44 г/моль
DH2(СО2) = 44 г/моль / 2 г/моль = 22
Відповідь. DH2(СО2)= 22
Задача 2. Обчислити відносну густину вуглекислого газу за повітрям.
Дано:
![]() СО2 Dпов = M(CO2)/M (пов)
СО2 Dпов = M(CO2)/M (пов)
![]() Dпов(CO2)-? M (пов) = 29г/моль
Dпов(CO2)-? M (пов) = 29г/моль
Mr(СО2) =1·Ar (C) + 2·Ar (H) = 12 + 2·16 = 44
M (CO2) = 44 г/моль
Dпов(СО2) = 44 г/моль / 29 г/моль = 1.5
Відповідь. Dпов(СО2)= 1.5
Задача 3. Обчислити відносну густину вуглекислого газу за киснем.
Дано:
![]() СО2 DО2 = M(CO2)/M (О2)
СО2 DО2 = M(CO2)/M (О2)
![]() DО2(CO2)-? Mr(СО2) =1·Ar (C) + 2·Ar (H) = 12 + 2·16 = 44
DО2(CO2)-? Mr(СО2) =1·Ar (C) + 2·Ar (H) = 12 + 2·16 = 44
M (CO2) = 44 г/моль
Mr(О2) =2·Ar (О) = 2·16 = 32
M (O2) = 32г/моль
DО2(СО2) = 44 г/моль / 32 г/моль = 1.38
Відповідь. DО2 (СО2)= 1.38
Задача 4. Відносна густина простої газоподібної речовини по водню 35.5.
Обчисліть молярну масу даної речовини.
Дано:
![]() DH2(Х)= 35.5 DH2 = M(Х)/M (H2)
DH2(Х)= 35.5 DH2 = M(Х)/M (H2)
![]() М (Х)-? М (Х) =DH2·M (H2)
М (Х)-? М (Х) =DH2·M (H2)
Mr(H2) = 2·Ar (H) = 2·1 = 2
M (H2) = 2 г/моль
М (Х) =35.5·2 г/моль = 71 г/ моль
Відповідь. М (Х) = 71 г/ моль
Завдання до заняття №7
1. Обчислити відносну густину кисню за воднем.
2. Обчислити відносну густину кисню за повітрям.
3. Обчислити відносну густину кисню за азотом.
4. Відносна густина простої газоподібної речовини по водню 8.
Обчисліть молярну масу даної речовини.
5. Обчисліть молярну масу даної речовини, якщо його відносна густина по водню рівно 15.
6. Чому повітряні кульки, заповнені воднем, підіймаються до гори ?
7. Аналіз показав, що сполука складається із 30, 43% Нітрогену і 69,57% Оксисену. Густина цієї речовини за повітрям дорівнює 46. Визначте молекулярну масу і формулу сполуки.
Тест самоконтролю до заняття №7
Виберіть одну правильну відповідь питання № 1-5.
1. Вкажіть символ, яким позначається відносна густина газів:
А NA;
Б Vm;
В N;
Г D
2. Вкажіть формулу за якою знаходять відносну густину газів:
А DО2 = M(CO2)/M (О2) ;
Б M = m∕n;
В m = M·n;
Г V = Vm·n
3. Вкажіть формулу газів який важче за повітря:
А СН4
Б NH3
В NO
Г СО
4. Вкажіть формулу газів який важче за кисень:
А Н2S
Б NH3
В NO
Г СО
5. Вкажіть формулу газів який легше за повітря:
А Н2S
Б NH3
В N2O5
Г СО2
Виберіть дві правильні відповіді № 6-7
6.Вкажітьформулигазів:
А H2;
Б CuO;
В Р2О5;
Г N2
7. Вкажіть формули газів:
А O2; Б MgO;
В Al2О3; Г F2
Виконайте завдання № 8-12
8. Встановіть відповідність між формулою газу та його відносною густиною за воднем:
Формула газу Відносна густина за воднем
-
 СO А8,5
СO А8,5
- СO2 Б14
- NH3 В22
Г 32
9. Встановіть відповідність між формулою газу та його відносною густиною за воднем:
Формула газу Відносна густи на за воднем
 1NO2 А 35,5
1NO2 А 35,5
2 SO2 Б 14
3 Сl2 В 23
Г 32
10. Установіть послідовність зростання значення відносної густини за воднем:
 А азот (N2);
А азот (N2);
Бкисень (О2);
В водень;
Г метан (СН4);
11. Встановіть відповідність між формулою газу та його відносною густиною за киснем:
Формула газу Відносна густина за киснем
 1 СO А 0.53
1 СO А 0.53
2 СO2 Б1.4
3 NH3 В 0.88
Г 1.38
12.Встановіть відповідність між формулою газу та його відносною густиною за повітрям :
Формула газу Відносна густина за киснем
 1 СO А 0.53
1 СO А 0.53
2 СO2 Б1.5
3 NH3 В 0.97
Г 0.59
Критерії оцінювання до тесту для самоконтролю заняття № 7
- завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань — 3 бали;
- завдання 7–9 оцінюються по 1балу, разом за дев’ять правильно виконаних завдань — 6 балів;
- завдання завдання10-12 оцінюються по 2 бали, разом за всі правильно виконаних завдань — 12 балів.
Відповіді до тесту самоконтролю заняття № 7
|
№ питання |
Відповідь |
Кількість балів |
|
1 |
Г |
0.5 |
|
2 |
А |
0.5 |
|
3 |
В |
0.5 |
|
4 |
А |
0.5 |
|
5 |
Б |
0.5 |
|
6 |
А,Г |
1 |
|
7 |
А,Г |
1 |
|
8 |
1-Б, 2-В, 3-А |
1.5 |
|
9 |
1-В, 2-Г, 3-А |
1.5 |
|
10 |
1-В, 2-Г, 3-А, 4-Б |
1.5 |
|
11 |
1-В, 2-Г, 3-А, |
1.5 |
|
12 |
1- В; 2- Б; 3- Г |
1.5 |
Презентація до заняття № 7



Заняття №8 «Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакцій. »
Тема: Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакцій.
Цілі:продовжувати формувати уявлення учнів про хімічне поняття «молярна маса речовини»; порівнювати кількісні значення молярної маси та відносної атомної та молекулярної маси речовини; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв’язок між кількістю речовини, формувати вміння застосовувати набуті знання під час розв’язування розрахункових задач, розвивати вміння робити висновки, виділяти головне, розвивати абстрактне й образне мислення.
Інструкція до заняття №8
Для успішного вивчення теми заняття №8 «Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакцій» необхідно:
1.Вивчити теоретичний матеріал.
2. Повторити способи добування та хімічні властивості кисню.
3. Зробити опорний конспект
4. Вивчити основні поняття.
5. Виконати практичне завдання
6. Відповісти на питання тесту для самоконтролю «Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакцій».
Теоретичний матеріал до заняття №8
1. Згадаємо матеріал 7 класу, способи добування кисню в лабораторії та реакції розкладу.
У лабораторії кисень одержують у невеликих кількостях. Для цього використовують речовини, які легко розкладаються з виділенням кисню незалежно від того, зустрічаються вони в природі чи добуті штучно. Для одержання кисню в лабораторії використовують термічно нестійкі оксиди, солі й інші речовини.
а) Розклад калій перманганату.
Розповідь вчителя.
2KMnO4= K2MnO4 + MnO2 +O2 ↑
б) Розклад оксидів важких металів. Оксиди важких металів розкладаються під дією температури: 2Нg0 = 2Нg + O2 ↑ в) Розклад гідроген пероксиду. Розклад гідроген пероксиду відбувається швидше в присутності манган(ІV)оксиду.
MnO2
2Н2О2→2Н2О + О2↑
Речовини, які змінюють швидкість реакції (збільшують або зменшують її), але самі при цьому не витрачаються, називаються каталізаторами.
г) Розклад індійської (або чилійської) селітри
Кисень виділяється під час нагрівання селітри:
2КNO3 = 2КN02 + 02 ↑
Крім того, що в результаті всіх раніше розглянутих реакцій виділяється кисень, вони мають ще одну спільну ознаку: в лівій частині рівняння записана одна речовина, а в продуктах - декілька. Реакції, в результаті яких з однієї складної речовини утворюються декілька інших речовин (простих або складних), називаються реакціями розкладу.
2. А зараз ми розглянемо процес взаємодії кисню з деякими простими речовинами:
а) взаємодія з вуглецем
С +О2 =СО2– карбон (IV) оксид
б) взаємодія з сіркою
S+ O2= SO2 – сульфур (IV) оксид
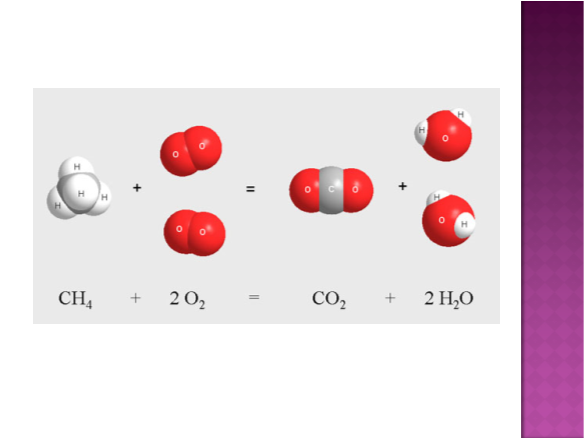
в) взаємодія з воднем 2Н2 + О2 =2 Н2О – гідроген оксид або вода
г) взаємодія з магнієм
2Мg +O2= 2MgO – магній оксид
д) взаємодія з залізом
2 Fe + O2=2FeO 4Fe +3O2=2Fe2O3 3 Fe +2 O2= Fe3O4
е) взаємодія з міддю 2Cu+ O2=2CuO - купрум (II) оксид Подивіться уважно на записані рівняння хімічних реакцій і скажіть,що у них є спільного?
Всі хімічні реакції належать до одного типу – реакції сполучення. Реакції сполучення – це реакції між двома простими речовинами, в результаті яких утворюється одна нова складна речовина.
Ти вже знаєш, що хімічне рівняння — умовний запис хімічної реакції
за допомогою хімічних формул. Його складають на основі закону збереження маси речовин, згідно з яким маса речовин, що вступають у реакцію, дорівнює масі речовин, що утворюються внаслідок реакції. Добираючи коефіцієнти до формул речовин, ти зрівнюєш число атомівкожного елемента в лівій і правій частинах і дістаєш хімічне рівняння, що відповідає закону збереження маси.
Пам'ятай! Для розрахунків важливо обирати такі одиниці вимірювання маси, об'єму, кількості речовини, які відповідають одна одній
За хімічним рівнянням можна робити різні розрахунки — обчислювати кількість речовини, масу, об'єм вихідних речовин або продуктів
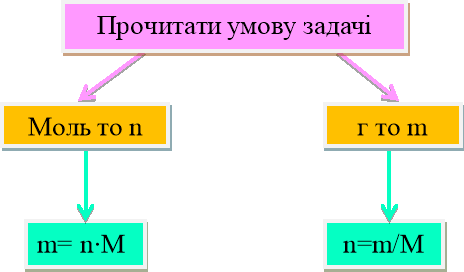
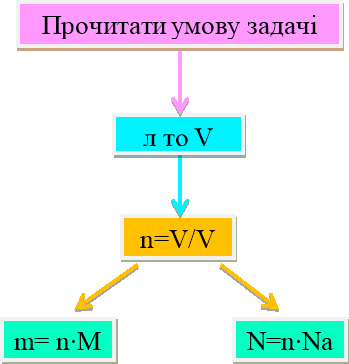
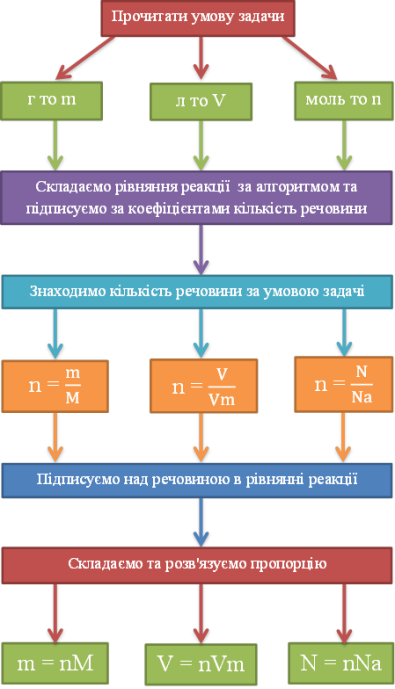
Практичне застосування щодо реалізації набутих теоретичних знань. Алгоритм розв'язання задач
1.Прочитати умову задачи.
2. Записати коротку умову, звертаючи увагу на цифри
…г то m
…л то V
…моль то n.
3.Записати потрібні формули:
n=![]() n=
n=![]() n=
n=![]()
4. У формулі обвести колом що «Дано»
5.Складаємо рівняння реакції за алгоритмом.
6. Підписати за коефіцієнтами кількість речовини за рівнянням.
7. Знаходимо кількість речовини за умовою задачі:
n=![]() n=
n=![]() n=
n=![]()
8. Підписуємо над речовиною в рівнянні реакції кількість речовини.
9. Складаємо та розв'язуємо пропорцію.
10.Підставляємо до формули і знаходимо що потрібно по умові задачі:
m= nM V=nVm N=nNa
11. Записати відповідь.
Задача 1.Обчисліть кількість речовини та кількість атомівкалію масою 68.25 г.
![]() Дано:
Дано:
M(К)= 68.25 г n =m/MN = n·Na
![]() n(K) = 68.25 г/39 г/моль= 1.75 моль
n(K) = 68.25 г/39 г/моль= 1.75 моль
n= (K)- ? Mr(К) = Ar(К) =39
N= (K)- ? M(К)= 39г/моль
N (K) = 1.75моль·6.02·1023моль-1= 10.5·1023
Відповідь.1.75 моль кількість речовини та10.5·1023 кількість атомів калію
Задача 2.Яка маса відповідає 10.54·1023 молекул сульфур (VI) оксидуSO3?
![]() Дано:
Дано:
N (SO3)=10.54·1023 n = N/Nam = n·M
![]() n(SO3) = 10.54·1023 / 6.02·1023моль-1= 1.75 моль
n(SO3) = 10.54·1023 / 6.02·1023моль-1= 1.75 моль
m (SO3)- ? Mr (SO3) = Ar(S) + Ar (O) =32 +3· 16 =80
M(SO3 )= 80 г/моль
m (SO3) = 1.75моль· 80 г/ моль=140 г
Відповідь. 140 г маса сульфур (VI) оксидуSO3.
Задача 1.Який об’єм сульфур (ІV) оксиду утворився під час спалювання сірки масою72 г?
![]() Дано:
Дано:
m (S)=72 г n = m/MV = n·Vm
![]() 2.25 моль х моль
2.25 моль х моль
V(SO2)-? S +O2 = SO2
1 моль 1 моль
M(S)=32 г/моль
n(SO2) = 72г/32 г/моль = 2.25 моль
Складаємо та розв'язуємо пропорцію:
2.25 моль_ х моль
1 моль 1 моль
х = 2.25 моль
V(SO2) =2.25 моль·22,4 л/моль= 50.4 л
Відповідь.V(SO2) =50.4 л
Задача 2 Яку масу воді необхідно розкласти електролізом для отримання кисню об’ємом 33.6 л?
![]() Дано:
Дано:
V (O2) = 33.6 л n = V/Vmm = n·M
![]() х моль 1.5 моль
х моль 1.5 моль
m(H2O)-? 2H2O> 2H2 + O2
2моль 1 моль
n(O2) = 33.6 л / 22.4 л/моль = 1.5 моль
Складаємо та розв'язуємо пропорцію:
Х моль_ 1.5 моль
2 моль 1 моль
х = 3 моль
M (H2O) = 18 г/моль
m(H2O) =3 моль·18 г/моль= 54 г
Відповідь. m(H2O) = 54 г
Задача 3 Обчисліть масу фосфор (V) оксиду, що утвориться внаслідок взаємодії фосфору з 72.8 л кисню
![]() Дано:
Дано:
V (O2) = 72.8 л n = V/Vmm = n·M
![]() 3.25 моль х моль
3.25 моль х моль
m(Р2O5)-? 4 Р + 5O2= 2 Р2О5
5моль 2 моль
n(O2) = 72.8 л / 22.4 л/моль = 3.25 моль
Складаємо та розв'язуємо пропорцію:
3.25моль_ х моль
5 моль 2 моль
х =1.3 моль
M (Р2O5) =142г/моль
m (Р2O5) = 1.3 моль·142 г/моль= 184.6 г
Відповідь. m (Р2O5) = 184.6 г
Завдання до заняття №8
1. Який об’єм сульфур (ІV) оксиду утворився під час спалювання сіркимасою24 г?
2. Яку масу воді необхідно розкласти електролізом для отримання кисню об’ємом 5.6 л?
3. Обчислітьоб’єм карбон (II) оксиду, що вступить в реакцію з 2,5 л кисню та об’ємодержаного карбон (IV)оксиду.
4. Обчисліть масу фосфор (V) оксиду, що утвориться внаслідок взаємодії фосфору з 5,6 лкисню
5. Обчислітьмасуферум (III) оксиду, щоутвориться при взаємодіїзаліза з 17,92 лкисню.
6. Обчисліть об’єм кисню, що за нормальних умов узаємодіє з воднем об’ємом 3 л.
Узагальнюючий тест з теми: «Кількість речовини. Розрахунки за хімічними формулами»
2. У кисні O2 кількістю речовини 2 моль міститься:
А 6,02·1023 молекул;
Б 3,01·1023 молекул;
В 12,04·1023 молекул;
Г 9,03·1023 молекул.
3. Молярна маса НСl:
А 36,5 г/моль;
Б 35,5 г/моль;
В 73 г/моль;
Г 15 г/моль.
4. 3 моль азоту за н. у. займає об’єм:
А 67,2 л;
Б 22,4 л;
В 89,6 л;
Г 44,8 л.
5. Одиниця вимірювання молярної маси — ...
6. Зв’язок між кількістю речовини й числом молекул описується формулою: ...
7. Обчисліть кількість речовини вуглекислого газу CO2 масою 2,2 г.
8. Обчисліть відносну густину амоніаку NH3 за воднем H2.
9. Встановіть відповідність між масою та кількістю речовини: Маса речовини Кількість речовини
 118г H2O; А 0,5моль;
118г H2O; А 0,5моль;
2 22г СO2; Б 1моль;
3 3,6гН2О; В 1,2моль;
Г 0,2 моль
10.Встановіть відповідність між об’ємом та кількістю речовини:
Об’єм газів Кількість речовини
 1 22,4л; А 0,5моль;
1 22,4л; А 0,5моль;
2 11,2л; Б 2моль;
3 44,8л; В 1моль;
Г 5 моль
11. Обчисліть об’єм кисню, що витратиться на згоряння 60 г кальцію Са.
12. Обчисліть, у якій масі карбон (IV) оксиду міститься стільки ж молекул, скільки міститься атомів у фосфорі масою 3,1 г.
Критерії оцінювання до тесту для самоконтролю заняття № 8
- завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань — 3 бали;
- завдання 7–9 оцінюються по 1балу, разом за дев’ять правильно виконаних завдань — 6балів;
- завдання10-12 оцінюються по 2 бали, разом за всі правильно виконаних завдань — 12 балів.
Відповіді до тесту самоконтролю заняття №8
|
№ питання |
Відповідь |
Кількість балів |
|
1 |
Кількість речовин — це фізична величина, що визначається числом структурних частинок (атомів, молекул, йонів тощо), які містяться в даній порції речовини. |
0.5 |
|
2 |
В |
0.5 |
|
3 |
А |
0.5 |
|
4 |
А |
0.5 |
|
5 |
Г |
0.5 |
|
6 |
n = N / Na |
0.5 |
|
7 |
0.05 моль |
1 |
|
8 |
8.5 |
1 |
|
9 |
1-Б, 2-А, 3-Г |
1 |
|
10 |
1-В, 2-А, 3-Б |
2 |
|
11 |
16.8 л |
2 |
|
12 |
4.4 г |
2 |
Словник термінів до дистанційного курсу з теми «Кількість речовини. Розрахунки за хімічними формулами».
А
- Аніон — іон з негативним зарядом.
- Атом — електронейтральна найменша хімічно неподільна частинка речовини, що складається з позитивно зарядженого ядра й електронів.
- Атомна маса — це маса атома, виражена в атомних одиницях маси. Чисельно дорівнює відносній атомній масі, але має одиницю вимірювання — 1 а. о. м.
- Атомна одиниця маси (а. о. м.) — одиниця вимірювання маси надлегких частинок, що дорівнює 1/12 маси атома Карбону, тобто 1,67 ∙ 10-24 кг.
Б
- Бінарні сполуки — складні речовини, що складаються з атомів двох будь-яких елементів.
В
- Валентність — число хімічних зв’язків, що утворює атом з іншими атомами.
- Валентність вища — максимальне значення валентності, що може виявляти хімічний елемент, в багатьох випадках дорівнює номеру групи в Періодичній системі.
- Відносна густина газу — величина, що дорівнює відношенню густин або молярних мас двох газів.
- Відносна атомна маса — це безрозмірна величина, що дорівнює відношенню маси атома до 1/12 маси атома Карбону.
- Відносна молекулярна маса — це величина, що дорівнює відношенню маси молекули до 1/12 маси атома Карбону.
- Випаровування — процес зміни агрегатного стану з рідкого на газоподібний.
- Властивості — це ознаки, за якими речовини або тіла відрізняються одне від одного чи подібні одне до одного.
Г
- Галогени — хімічні елементи головної підгрупи VII групи.
- Гіпотеза — це судження про можливий зв’язок явищ, вона висувається для встановлення закономірностей між фактами і явищами.
- Горіння — швидкий процес окиснення речовин, що супроводжується виділенням великої кількості теплоти і світла.
- Група Періодичної системи — вертикальний ряд хімічних елементів, що об’єднує подібні за властивостями хімічні елементи.
Д
- Дистиляція — метод розділення двох (або більше) рідин, що змішуються. Суть методу полягає в тому, що суміш рідин нагрівають, в результаті чого рідина, що кипить за нижчої температури, починає випаровуватися раніше. Пара цієї рідини відводиться та охолоджується в холодильнику і краплями збираються у приймачі.
Е
- Експеримент — метод пізнання, за допомогою якого в певних умовах (найчастіше в таких, що спеціально створюються) отримують знання відносно зв’язку між явищами та об’єктами.
- Електричний струм — направлений потік електронів у речовині.
- Електроліз — процес розкладання розчинених або розплавлених речовин під дією електричного струму. Наприклад, електролізом води одержують водень та кисень, а електролізом розплаву натрій хлориду (кам’яної солі NaCl) — одержують прості речовини натрій та хлор.
- Електронегативність — властивість атомів притягувати спільну електронну пару (електрони).
- Електрони — елементарні частинки з електричним зарядом -1 та масою приблизно у 2000 разів меншою за масу протону чи нейтрону.
- Електронна конфігурація атома — умовний запис, що характеризує розподілення електронів в атомі по орбіталях.
- Електронна оболонка — група електронів, що рухаються навколо ядра атома.
- Елемент — див. Хімічний елемент.
- Елементи-метали — хімічні елементи, які в хімічних реакціях переважно віддають електрони.
- Елементи-неметали — хімічні елементи, які в хімічних реакціях переважно приймають електрони.
- Енергетичний рівень — сукупність електронів, що мають близьку енергію.
- Енергетичний підрівень — сукупність орбіталей з однаковою енергією.
З
- Закон — істотний, сталий і повторюваний зв’язок між явищами.
- Закон Авогадро — у рівних об’ємах будь-яких газів, що перебувають в однакових умовах (температура й тиск), міститься однакове число молекул.
І
- Індекс — число атомів певного елемента у складі молекули або формульної одиниці.
- Індикатор — речовина, що змінює своє забарвлення залежно від присутності іншої речовини в розчині (кислоти, лугу тощо). Найбільш поширені кислотно-основні індикатори — лакмус, фенолфталеїн.
- Інертні гази — хімічні елементи головної підгрупи VIII групи.
- Іони — одноатомні або багатоатомні частинки, що мають електричний заряд.
К
- Каталізатор — речовина, що бере участь у реакції і змінює її швидкість, але сама в реакції не витрачається. Каталізатори, що збільшують швидкість реакції, називають позитивними, а ті, що зменшують,— негативними (або інгібіторами). Найбільш поширений та універсальний каталізатор — платина.
- Катіон — іон з позитивним зарядом.
- Кількість речовини — фізична величина, що показує число структурних одиниць даної речовини (атомів, молекул, іонів тощо). Одиниця вимірювання — 1 моль. 1 моль будь-якої речовини містить 6,02 ∙ 1023 структурних одиниць.
- Коефіцієнт — показує число молекул (формульних одиниць), що вступають до певного процесу.
М
- Маса атома — це маса атома, виражена в грамах або кілограмах.
- Маса молярна — маса речовини кількістю 1 моль.
- Масова частка елемента — це величина, що показує, яка частка маси речовини або молекули припадає на атоми даного елемента.
- Матеріал — це речовина або суміш речовин, що використовується для виготовлення предметів.
- Метали — прості речовини, для яких характерні загальні фізичні властивості: металевий блиск, електропровідність, висока теплопровідність, пластичність тощо.
- Молекула — найменша частинка речовини, що є носієм всіх властивостей цієї речовини. Молекули складаються з атомів.
Н
- Нейтрони — субатомні частинки, що входять до складу ядра атома, не мають електричного заряду. Маса нейтронів дорівнює 1 атомній одиниці маси.
- Неметали — прості речовини, для яких характерні загальні фізичні властивості: відсутність електропровідності, крихкість, низька теплопровідність тощо.
- Нормальні умови — умови, за яких прийнято вказувати об’єм газів. Вони виявляють температуру 0 °С (273,15 °К) та тиск в 1 атмосферу (760мм рт. ст., або 101325 Па).
- Нуклід — це різновид атомів з певним числом протонів і нейтронів в ядрі.
- Нуклони — субатомні частинки, з яких складаються ядра атомів. Нуклони є двох видів: протони та нейтрони.
О
- Об’єм молярний — об’єм речовини кількістю 1 моль. Молярний об’єм будь-якого газу за нормальних умов дорівнює 22,4 л/моль.
- Оксиди — хімічні сполуки, що складаються з атомів двох хімічних елементів, один з яких — Оксиген.
- Орбіталь — це область простору, де ймовірність знаходження електрона вища за 90%.
П
- Період Періодичної системи — горизонтальний ряд елементів у Періодичній системі, що починається з типового металу і закінчується інертним газом.
- Плавлення — процес зміни агрегатного стану з твердого на рідкий.
- Перегонка — див. Дистиляція.
- Природничі науки — науки про природу, до них відносяться хімія, фізика, біологія, географія, геологія, астрономія та інші.
- Продукти реакції — це речовини, що утворюються під час хімічної реакції.
- Прості речовини — речовини, які складаються з атомів одного хімічного елемента.
- Протони — субатомні частинки, що входять до складу ядра атома, з електричним зарядом +1 та масою, що дорівнює 1 атомній одиниці маси (1 а. о. м.).
Р
- Реагенти — це речовини, що вступають в хімічну реакцію.
- Реакція розкладу — хімічна реакція, в результаті якої з однієї складної речовини утворюється дві (або більше) речовини.
- Реакція сполучення — хімічна реакція, в результаті якої з декількох речовин з відносно простим складом утворюється одна речовина зі складнішим складом.
- Речовина — різновид матерії, що характеризується певною будовою. Всі тіла складаються з речовин.
С
- Складні речовини — речовини, які складаються з атомів різних хімічних елементів.
- Спостереження — це активне, ціленаправлене та навмисне сприйняття об’єктів для отримання знань про їх зовнішні властивості та особливості.
Т
- Теорія — це комплекс поглядів або суджень, що описує, пояснює і передбачує будь-які явища.
- Тіла — всі предмети, що оточують нас.
Ф
- Фізичні явища — див. Явища фізичні.
- Формульна одиниця — група атомів, що записана у хімічній формулі. Термін «формульна одиниця» використовується для речовин з немолекулярною будовою.
Х
- Хімічний елемент — різновид атомів з однаковим зарядом ядра.
- Хімічні явища — див. Явища хімічні.
- Хімічний зв’язок — це взаємодія атомів, що здійснюється шляхом обміну електронами або їхнім переходом від одного атома до іншого.
- Хімія — наука про речовини та їх взаємоперетворення.
Ч
- Число Авогадро — число структурних одиниць, що містить речовина кількістю 1 моль.
Я
- Явища — всі зміни, що відбуваються навколо нас.
- Явища фізичні — це явища, під час яких не змінюється склад речовини (не змінюються молекули речовини).
- Явища хімічні — це явища, під час яких одні речовини перетворюються на інші (змінюються молекули речовин).
Список використаних джерел
- Програма для загальноосвітніх навчальних закладів, Хімія, 7 – 11 кл., Київ, «Перун», 2005
- Буринська Н.М., Хімія, 8 кл., Київ, Ірпінь, 2003
- Василенко С.В., Хімія, робочий зошит, Київ, «Абрис», 1999
- Гузик Н.П., Дидактический материал по химии (по лекционно-семинарской системе). – Київ, Радянська школа, 1982
- Григорович О.В. : Хімія. 8 клас. Плани-конспекти всіх уроків /О. Григорович, А. Віценцик, О. Гостиннікова — Х. : «Ранок», 2011. — 288
- Данильченко В.Є., Хімія, 8 – 9 кл., Харків, 2003
- Данильченко В.Є., Хімія, 7 – 8 кл., Навчальний посібник - Харків, «Країна мрій», 2007
- Липова Л.А., «Дидактичний матеріал з неорганічної хімії», Київ, 1996
- Попель П. П. Хімія : підручник для 8 класу загальноосвітніх навчальних закладів / П. П. Попель, Л. С. Крикля. — К. :, 2008. — 232 с.
- Гипермаркет знаний [Електронний ресурс]. – Режим доступу: http://school.xvatit.com
- Отримання знань [Електронний ресурс]. – Режим доступу: http://disted.edu.vn.ua/
- Шкільна бібліотека [Електронний ресурс]. – Режим доступу: http://schoollib.com.ua/


про публікацію авторської розробки
Додати розробку

