Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню
Тема: Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню (Відкритий урок)
Урок 29
Тема. Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню
Мета:
- сформувати поняття про реакцію розкладу та каталізатор на прикладі реакцій добування кисню; ознайомити учнів із добуванням кисню в промисловості, методиками визначення та збирання кисню,
- розвивати пізнавальний інтерес,
- виховувати самостійність.
Обладнання та реактиви: періодична система хімічних елементів Д. І. Менделєєва; лабораторний штатив із тримачем і лапкою, спиртівка, пробірки, газовивідна трубка, кристалізатор, скіпка, штатив для пробірок, вата, гідроген пероксид, манган(ІУ) оксид, вода.
Базові поняття та терміни: Оксиген, кисень, гідроген пероксид, каталізатор, реакція розкладу
Тип уроку: комбінований
Хід уроку
І. Організаційний момент. Вітання учителя з класом, перевірка відсутніх, оголошення теми уроку. (Слайд 1), ( Слайд 2)
ІІ. Мотивація навчальної діяльності
Родоначальник німецької класичної філософії Іммануїл Кант якось сказав: «Веселий вираз обличчя поступово відображається і на внутрішньому світі людини». Тому, дорогі учні, я дуже хотів би щоб ви зараз посміхнулись один до одного. Сподіваюсь, сьогоднішній урок буде цікавим і пізнавальним, а ви залишатиметесь у хорошому настрої.
III. Актуалізація опорних знань Доповніть речення, вставивши слова «Оксиген», «Кисень».
1.Формула О є - ?
- Форулою О2 є - ?
- Відносна атомна маса елемента _____ 16?
- Відносна молекулярна маса 32 належить сполуці _______?
- Найбільший вміст ____________ в гірських породах і мінералах.
- У воді розчинений __________________.
- В акваріумі риби дихають _______________, розчиненим у воді.
- До складу молекули води входить .
- Важчим за повітря є ______?
- Які елементи ми вивчаємо на протязі двох уроків????


![]()
![]()
IV. Вивчення нового матеріалу 1.Одержання кисню в промисловості. (Слайд 3) Розповідь учителя. У промисловості кисень одержують електролізом води та з повітря а) електролітичний метод Через воду пропускають електричний струм, під дією якого вона розпадається на водень та кисень: 2H2O ел. струм 2Н2 +О2 Для того, щоб вода проводила електричний струм до неї додають інші речовини (луги або сульфати лужних металі).

Рис.1. Установка для виробництва кисню методом електролізу води
б) розділення повітря. Цей метод ґрунтується на використанні різниці температури кипіння газів, з яких складається повітря. Спочатку зріджують повітря. Для цього його сильно стискають (100-200 атм.), а після цього різко знижують тиск. Внаслідок цього повітря сильно охолоджується й переходить у рідкий стан (при температурі -192 °С). Рідке повітря переганяють у ректифікаційній колоні. Оскільки азот кипить при -196 °С, а кисень - при -183 °С, із рідкого повітря спочатку відганяється азот, а потім кисень.

Рис.2. Установка для одержання кисню із повітря (киснева станція)
2.Методи збирання кисню (Слайд 4)
Розповідь учителя. Існує два методи збирання кисню: метод витіснення повітря та метод витіснення води. а) метод витіснення повітря Кисень важчий від повітря, отже посудину-приймач слід тримати дном донизу. Кисень буде опускатися на дно посудини витісняючи повітря, що міститься в ній. б) метод витіснення води. Посудину-приймач заповнюють водою по вінця. Закривають та перевертають догори дном. Опустивши отвір посудини у кристалізатор з водою, її відкривають під водою. Вода тримається у посудині. Знизу через трубку надходить кисень, який піднімається вгору, виштовхуючи воду.
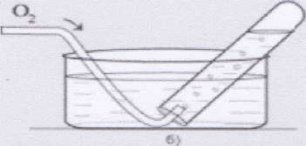
Рис.3. Збирання кисню методом витіснення води
![]()
![]() 3.Виявлення кисню (Слайд 5) Розповідь учителя. Кисень підтримує горіння. Тому тліюча скіпка спалахує, щойно стикається з киснем.
3.Виявлення кисню (Слайд 5) Розповідь учителя. Кисень підтримує горіння. Тому тліюча скіпка спалахує, щойно стикається з киснем.
4.Одержання кисню в лабораторії (Слайд 6)
Розповідь учителя. У лабораторії кисень одержують у невеликих кількостях. Для цього використовують речовини, які легко розкладаються з виділенням кисню незалежно від того, зустрічаються вони в природі чи добуті штучно. Для одержання кисню в лабораторії використовують термічно нестійкі оксиди, солі й інші речовини.
а) Розклад калій перманганату.
Розповідь вчителя.
2KMnO4= K2 MnO 4 + MnO2 +O2 ↑
б) Розклад оксидів важких металів. Розповідь учителя. Оксиди важких металів розкладаються під дією температури: 2Нg0 = 2Нg + O2 ↑ в) Розклад гідроген пероксиду. Розповідь учителя. Розклад гідроген пероксиду відбувається швидше в присутності манган(ІУ)оксиду.
MnO2
2Н202 →2Н20 + 02↑
Демонстрація. Добування кисню з гідроген пероксиду. У пробірку наливається невелика кількість (2-3 мл) 3—5%-го розчину гідроген пероксиду. За кімнатних умов з розчину гідроген пероксиду повільно виділяється кисень. Потім за тих самих умов демонструється дія каталізатора: у пробірку поміщається невелика кількість манган(ІУ) оксиду. При цьому спостерігається сильне виділення кисню.
Розповідь учителя. Речовини, які змінюють швидкість реакції (збільшують або зменшують її), але самі при цьому не витрачаються, називаються каталізаторами.
Демонстрація. Виявлення кисню. Опустимо тліючу скіпку в пробірку заповнену зібраним у попередньому досліді киснем. Скіпка спалахне.
Реакції розкладу Розповідь учителя з елементами бесіди. Крім того, що в результаті всіх раніше розглянутих реакцій виділяється кисень, вони мають ще одну спільну ознаку (яку?),(відповіді учнів): в лівій частині рівняння записана одна речовина, а в продуктах - декілька. Реакції, в результаті яких з однієї складної речовини утворюються декілька інших речовин (простих або складних), називаються реакціями розкладу.
V. Узагальнення й систематизація знань
1.Бесіда.
1. Яким чином одержують кисень в лабораторії?
2. Яким чином кисень одержують в промисловості?
3. Які речовини називають каталізаторами?
4. Де в повсякденному житті ми стикаємося з дією каталізаторів?
5. Які реакції називають реакціями розкладу?
2. Заповнення «Карта знань».
«Карта знань»
|
|
|
|
Лабораторний спосіб |
Промисловий спосіб |
|
1. Розклад меркурій(ІІ) оксиду(HgO) :
|
1.Електроліз води: |
|
2. Розклад калій перманганату (KMnO4):
|
2. Низькотемпературне розділення повітря: |
|
3. Розклад гідроген пероксиду (H2O2):
|
|
|
4. Розклад калій хлората (бертолетова сіль) (HClO3) :
|
|
|
5. Розклад калій нітрату (індійська селітра)( KNO3):
|
|
3. Виконання вправи
.Нітратна кислота має формулу HNO3. Під дією світла вона розкладається. При цьому утворюються такі речовини: вода, кисень, газ бурого кольору NO2. Напишіть рівняння реакції.
VI. Підсумок уроку.
Перевірка карток знань та виставлення оцінок.
VII. Домашнє завдання
Опрацювати параграф підручника №20 та виконати завдання після нього на стр.123 (№ 146 – 149).


про публікацію авторської розробки
Додати розробку
