Електричний струм у електролітах
Про матеріал
Дана презентація може бути використана на уроці фізики у 8 класі при вивчені теми "Електричний струм у електролітах". Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
До підручника
Фізика 8 клас (Бар’яхтар В. Г., Божинова Ф. Я., Довгий С. О., Кі-рюхіна О.О. (за ред. Бар’яхтар В. Г., Довгого С.О.))
До уроку
§ 37. Електричний струм в електролітах Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



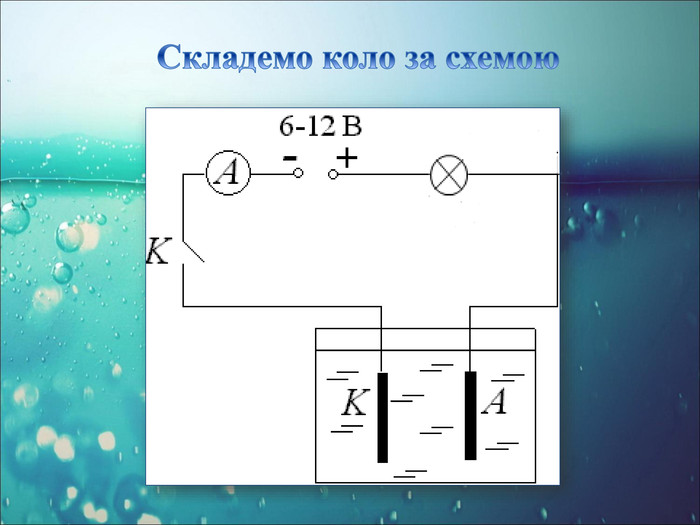


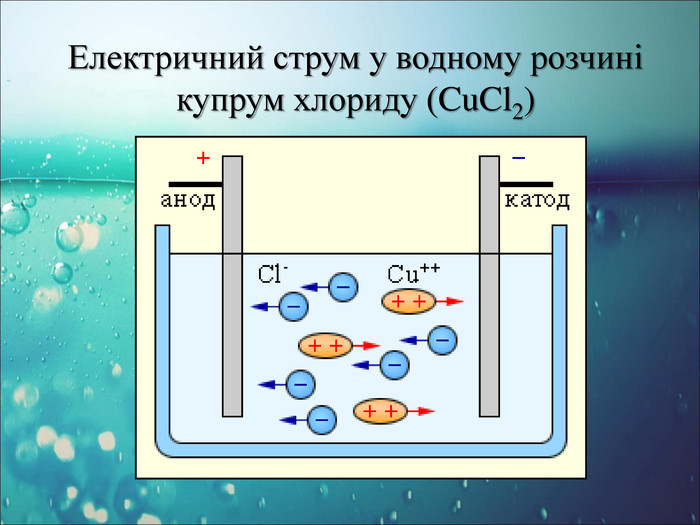




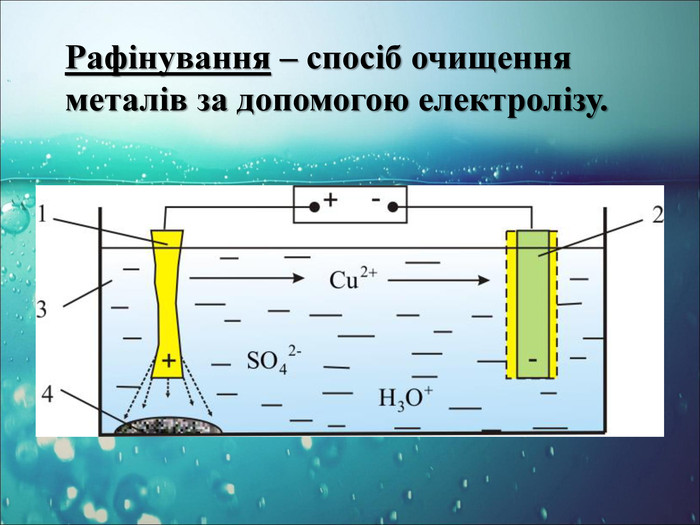
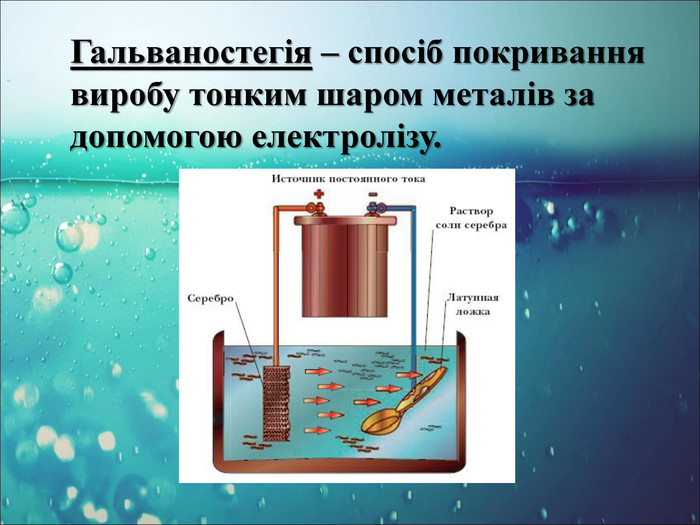
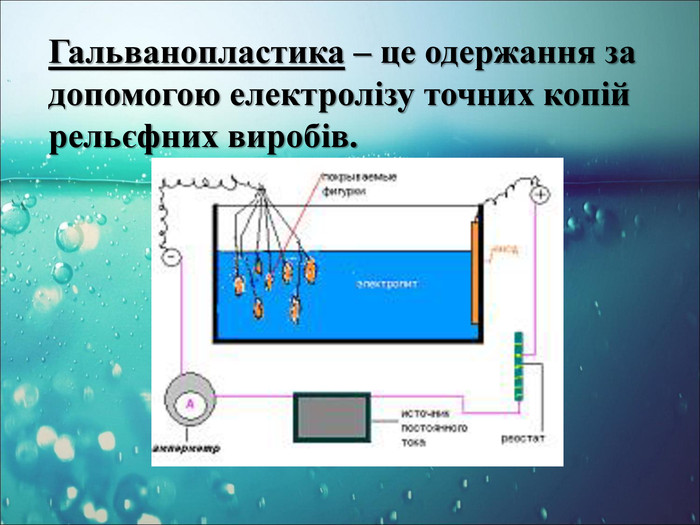








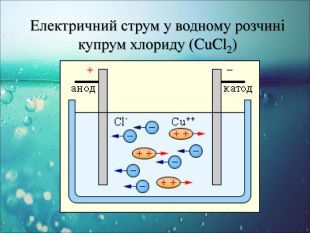




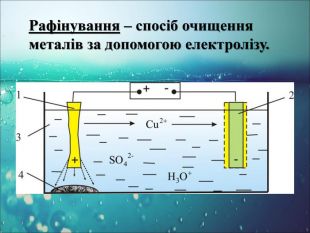

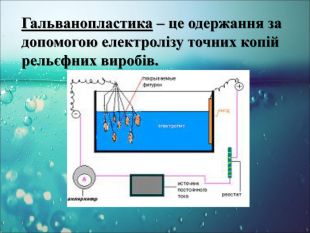



-

Павлюк Наталія Степанівна
09.05.2025 в 12:05
дякую
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Румянцева Оксана Василівна
09.05.2024 в 08:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бондар Галина
26.04.2023 в 17:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Зарейчук Світлана Іванівна
11.10.2022 в 11:26
Структурованість 5.0
Оригінальність викладу 4.7
Відповідність темі 5.0
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Горовий Іван
15.11.2021 в 16:13
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Перепелиця Любов Василівна
25.09.2021 в 20:27
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лимаренко Віра Іванівна
14.04.2020 в 10:51
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 4 відгука