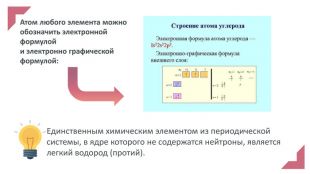
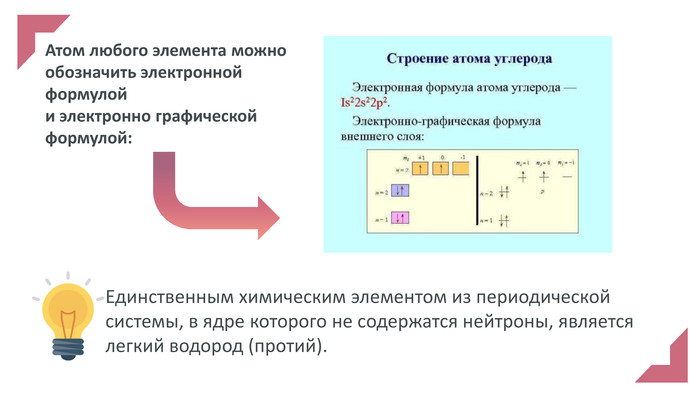
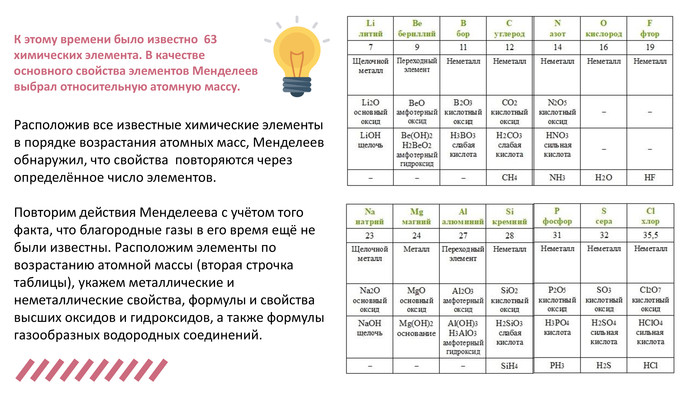
Електронна презентація до уроку хімії у 7 класі на тему "Будова атома у світі Періодичного закону"
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку













 Dinosoft. Labs from
Dinosoft. Labs from