Енергетичний стан електрона в атомі. Будова електронних оболонок атомів. Електронні формули.
Про матеріал
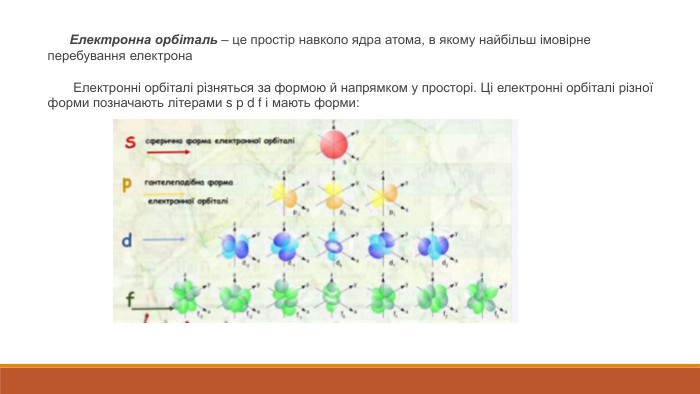
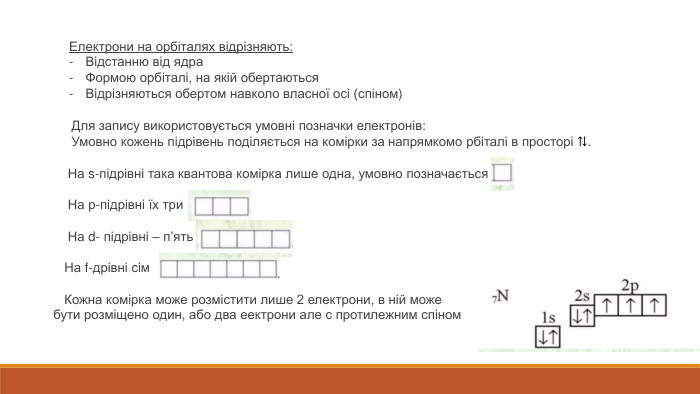
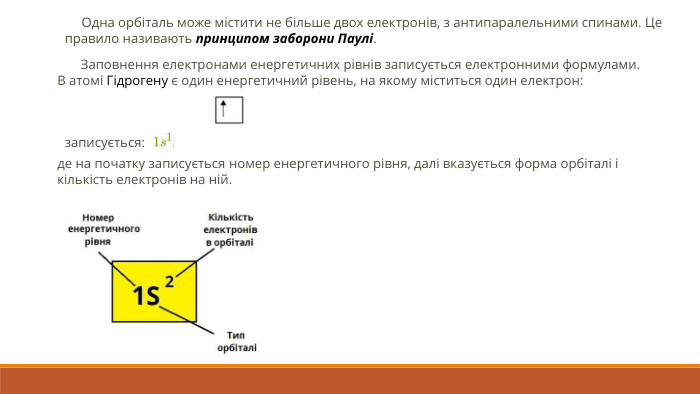
Розкрита суть планетарної моделі атома. Наведено основні поняття та данні про стан електронів в атомі, а також електронні орбіталі Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку