Естери, жири, мила, СМЗ


































Мета заняття: Дидактична:• ознайомити здобувачів освіти зі складом і властивостями естерів та жирів, їх розповсюдженням і застосуванням; а також біологічним значенням;• розкрити поняття про вітаміни з точки зору хімії жирів;• ознайомити зі складом і властивостями мила та СМЗ;• з’ясувати яким вимогам повинен відповідати сучасний СМЗ з екологічної точки зору.
Мета заняття: Навчально-розвиваюча:• стимулювати зацікавленість здобувачів освіти у вивченні предмета шляхом упровадження інноваційних технологій (відео презентація, міні-проекти)• формувати хімічну мову, вміння самостійно складати рівняння хімічних процесів;• розвивати у здобувачів освіти самостійність у навчанні, вміння узагальнювати факти, використовуючи знання про склад, будову та властивості естерів, жирів та мил;• розвивати творче мислення, вміння порівнювати та аналізувати;• розглядати набуті знання не в площині отримання нових знань в окремому предметі, а розширювати свій світогляд, розуміючи міжпредметні взаємозв’язки . Формувати загальнонаукове сприйняття всесвіту.
Мета заняття: Виховна:• заохочувати здобувачів освіти допомагати один одному вчитися навчаючи;• сприяти формуванню активної життєвої позиції, вмінню висловлювати і аргументовано відстоювати свою точку зору;• розвивати вміння як самостійної роботи , так і роботи в групах, ефективно використовуючи знання і час;• формувати у здобувачів освіти розуміння важливості отриманих знань з наданої теми, можливості їх використання у житті.
Тема:« Естери, жири, мила. СМЗ»План :1. Естери (фізичні властивості та знаходження в природі; будова та отримання; хімічні властивості та застосування).2. Жири (знаходження в природі та класифікація; біологічні функції ; фізичні властивості; добування та хімічні властивості; застосування).3. Мила ( історія виникнення; склад та добування; властивості).4. СМЗ ( склад; порівняння властивостей та мийної дії мила та СМЗ; мийні засоби та навколишнє середовище).
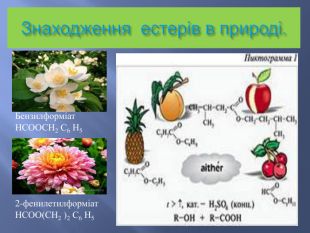
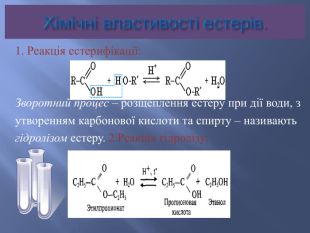
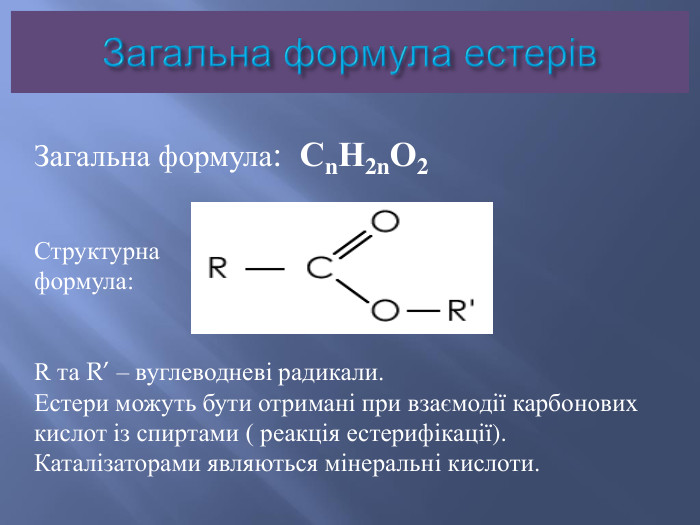
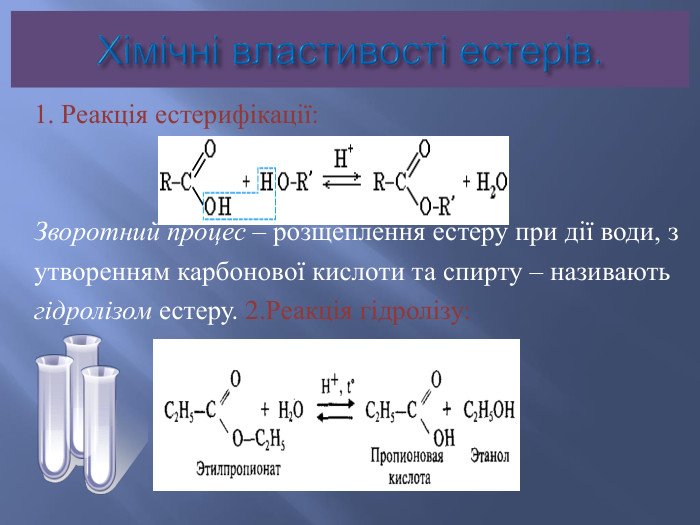
Номенклатура естерів. Назви естерів утворюються із назв відповідних кислот та спиртів. Спочатку вказується група R’,приєднана до кислоти, потім назва кислоти з суфіксом – ат. Іноді вживають тривіальні назви ,виходячи з того, що естер розглядається як продукт карбонової кислоти та спирту. Наприклад: етилетаноат , або етиловий естер оцтової кислоти.
Ізомерія та номенклатура естерів.Ізомерія карбонового скелету: CH3 – COO – CH2 – CH2 – CH3пропилацетат ,або пропилетаноат, абопропиловий естер оцтової кислоти. CH3 – COO – CH – (CH3)2ізопропилацетат, або ізопропилетаноат , абоізопропиловий естер оцтової кислотиІзомерія положення функціональної групи: C2 H5 – COO – C2 H5 Етилпропіонат, або етилпропаноат, абоетиловий естер пропіонової кислоти. CH3 – CH2 – CH2 – COO – CH3 Метилбутират, або метилбутаноат, або метиловий естермасляної кислоти
Застосування естерів. В промисловості в якості розчинників (етилформіат, етилетаноат) та проміжних продуктів при синтезі різноманітних органічних сполук;В парфумерній та харчовій промисловості (ароматизатори )В фармакології (воски входять до складу косметичних кремів і лікарських мазей).
Застосування жирів.• Харчова промисловість. Жири як коштовний харчовий продукт ; одержання маргарину.• Медицина. Жири лікарського значення (риб'ячий жир, обліпихова олія та ін.) , а також як основи для лікарських препаратів, або їх компоненти.• Миловаріння. Одержання мила. • Виробництво свічок.• Виробництво гліцерину та карбонових кислот.• Лакофарбова промисловість. Одержання оліфи, лаків, фарб, мастил, а також леноліумів.• Парфумерно-косметична промисловість.
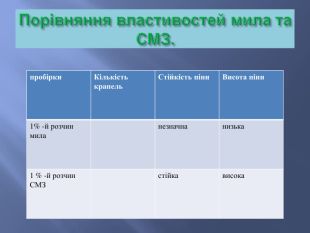
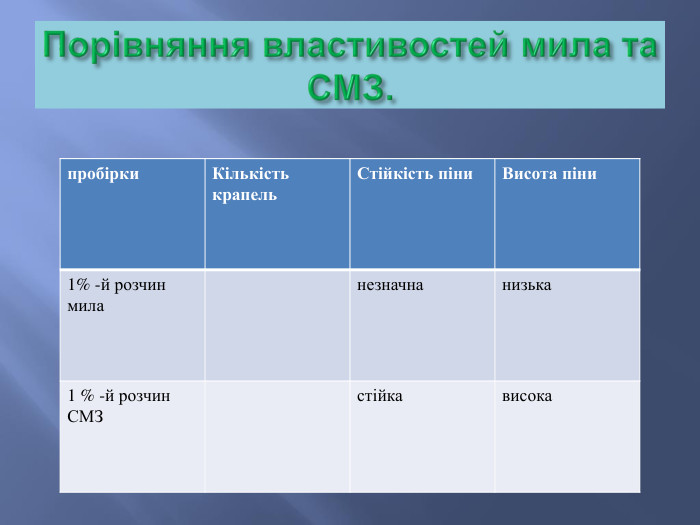
Мийна дія мила.1ё111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111 Ё Мийна дія мила. Молекула мила містить полярні й неполярні частини іорієнтуються в водному розчині неполярною (гідрофобною)частиною на бруд, а полярною (гідрофільною) – намолекули води. Ці групи – гідрофільні та гідрофобні –знаходяться на різних кінцях довгої молекули мила . Такімолекули прикріплюються своїми гідрофобними кінцями добруду, а гідрофільні тирчать назовні , як голки у їжака.
Мийний процес. а- частка бруду на поверхні тканини;б- адсорбція мийної речовини на частці бруду;в- відрив частки бруду від забрудненої поверхні;г- частка бруду в мийному розчині;д- пухирці повітря з адсорбованими молекулами мийної речовини (піна);е- злиплі пухирці піни й частки бруду;ж- адсорбційний прошарок мийного розчину на межі розподілу: повітря – вода.
Систематизація отриманих знань.1. Дайте назву наведеним естерам:1) С4 Н9-СОО-С5 Н11; 2) С3 Н7-СОО-С2 Н5; 3) СН3-СОО-С2 Н5; 4) Н-СОО-С2 Н5.2. Загальна формула естерів: 1) Cn. H2n. O 2) Cn. H2n. O2 3)Cn. H2n+2 O 4) Cn. H2n3. Естери – це продукт взаємодії: 1) карбонових кислот та альдегидів; 2) спиртів та альдегидів; 3) карбонових кислот та спиртів;4. Хто із наступних вчених займався вивченням жирів? 1) Менделєєв; 2) Шеврель; 3) Бутлеров; 4) Бертло.5. Серед наведених речовин укажіть можливі продукти гідролізу жирів: 1) гліцерин; 2) вода; 3) стеаринова кислота; 4) карбон (ІV) оксид.6. Назвіть речовину, з допомогою якої рідкі жири перетворюються на тверді:1) вода; 2) питна сода; 3) водень; 4) оцтова кислота.7. Яка з наведених структур відповідає молекулі жиру? 1) 2) 3) 8. Назвіть основні біологічні функції жирів.9. Мило належить до класу: 1) солей; 2) спиртів; 3) естерів; 4) карбонових кислот.10. Яка особливість будови молекул мил та СМЗ зумовлює їх миючу дію?
Література.1. Н. М. Буринська, Л. П. Величко. Хімія 11. Київ, Ірпінь: ВТФ "Перун", 2019.2. Грандберг И. И. Органічна хімія. Розділ: “Ліпіди” М.: “Вища школа” 1990р. 3. 3. Мартиненко Б. В. Хімія й здоров'я М.: Освіта 1988р. Розділ “Жири й здоров'я”. 4. Волков В. А. й ін. Хіміки « Біографічний довідник». Київ 1984 р.5. 5. Загальна та органічна хімія: конспект лекцій: у 2 ч. / уклад.: Л.І. Марченко, С. Б. Большаніна. – Суми : Сумський державний університет, 2014 – . – Ч. 2. – 2014. – 105 с. 8. Комов В. П. Биохимия: учеб6. Гроссе Е. «Хімія для допитливих»Л.: “Хімія” 1987р. 7. Біологія : 10 кл. : Підруч. для загальноосвіт. навч. закл. : П. Г. Балан, Ю. Г. Вервес, В. П. Поліщук. – К. : Генеза, 2019. – 288 с. : іл.8. Органічна хімія і екологія: навчальний посібник: у 2 ч. / А. П. Ранський. – Вінниця : ВНТУ, 2012 –. – Ч.1 : Теоретичні основи органічної хімії. Аліфатичні вуглеводні. – 2012. – 120 с. 9. О. Ольгин. "Опыты без взрывов". М., "Химия", 1986 Інформаційні ресурси1. Основні поняття, закони й теорії хімії. − Режим доступу: http://shkolnik.in.ua/2009-09-03-16-48-01.html


про публікацію авторської розробки
Додати розробку