Ферум – найважливіший d-елемент, його хімічні властивості. Фізичні властивості заліза. Оксиди Феруму. Сполуки Феруму у природі. Оксиди Феруму. Залізо, його властивості і використан
Тема: Ферум – найважливіший d-елемент, його хімічні властивості. Фізичні властивості заліза. Оксиди Феруму. Сполуки Феруму у природі. Оксиди Феруму. Залізо, його властивості і використання.

Мета:
Навчальна: закріплення знань про будову хімічного елементу за розміщенням в ПС;
спираючись на знання залежності властивостей металів від будови їх атомів, передбачити характерні хімічні властивості Феруму; ознайомити учнів із застосуванням заліза та їх сполук в побуті та виробництві, значенням їх у життєдіяльності людини; розширити знання про реакції сполучення на прикладі взаємодії заліза з простими речовинами.
Виховна: розвиток пізнавального інтересу, уміння працювати в групі.
Розвиваюча: продовжувати розвивати вміння та навички складати опорні схеми; урівнювати хімічні рівння.
Методи навчання.
- Словесні: розповідь-пояснення, бесіда.
- Наочні: мультимедійна презентація
- Практичні: розв’язування тестів, рівнянь реакцій та задач.
Унаочнення: підручники, колекція „Феруму”
Тип уроку: урок засвоєння нових компетенцій.
І. Організаційний момент. Привітання. Перевірка присутніх учнів на уроці.
ІІ. Мотивація навчальної діяльності.
«Можна не любити хімію, але прожити без неї сьогодні й завтра неможливо.» (О.М.Нефедов)
- Яку будову має речовина?
- На які дві групи можна поділити всі хімічні елементи?
- Як у періодичній системі розрізнити метали та неметали?
- Де давні люди використовували вироби з металів?
- А де використовуються металеві вироби сьогодні?
- Чи ви в професійній діяльності маєте справу з металами?
Оголошення теми уроку, мети уроку.
ІІІ. Вивчення нового матеріалу.
Охарактеризуйте хімічний елемент Ферум відповідно до положення в періодичній системі:
- Де в періодичній системі розташований Ферум?
- Скільки металів входить до цієї підгрупи? Чому ж ми вивчаємо тільки Fе?
Мета нашої подальшої роботи з’ясувати це!!!
Щоб вирішити завдання треба досліджувати всі відомі дані:
Що нам відомо про Ферум як хімічний елемент?
1. Положення в ПС
Група, період – 8 група, побічна підгрупа
Хімічний елемент: Fе — Ферум.
Відносна атомна маса: 56.
Порядковий номер: 26.
Проста речовина: Fе — залізо.
2.Напишіть схему електронної будови атома:
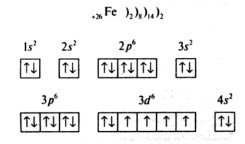
Валентність: II або III.
- Які ступені окислення Fе в сполуках?(+2,+3)
Шкала ступенів окислення.
Що можна сказати про фізичні властивості заліза?

Дослід 1. Вивчення фізичних властивостей заліза.
Інструктаж з техніки безпеки.
Дослід 1. Розгляньте зразки заліза в колекції й опишіть фізичні властивості заліза за планом:
• агрегатний стан (твердий);
• колір (сірий);
• блиск (є);
• запах (немає);
• твердість (твердий, тугоплавкий);
• дія магнітом (має магнітні властивості).
Дослід 2. Вивчення розчинності заліза у воді.
Шматочок заліза занурте в пробірку з водою. Що відбувається? Закріпіть пробірку в пробіркотримачі. Дотримуючись правил нагрівання, прогрійте пробірку, а потім акуратно підігрійте до кипіння і приберіть з вогню. Що сталося зі шматочком заліза? (Нерозчиняється у воді) Зробіть висновок про фізичні властивості заліза.
Вивчені нами експериментально фізичні властивості заліза записуємо до таблиці.
Знаючи склад і будову молекули речовини можна спрогнозувати його хімічні властивості.
Хімічні властивості заліза розглянемо на прикладі взаємодії заліза з неметалами: киснем і сіркою.
Хімічні реакції.
1. Взаємодія заліза із сіркою. Запишемо рівняння хімічної реакції. Fе + S = FeS
2.Взаємодія заліза із киснем. Запишемо рівняння хімічної реакції. 2Fе + О2 = 2FeО
3. Залізо розчиняється в кислотах. При цьому виділяється водень. Складемо відповідні рівняння реакції.
4.Взаємодія з солями: Fе + CuSO4 = FeSO4 + Cu
Запитання до учнів: 1.Завдяки чому відбувається ця реакція? 2. Чому мідь може витісняти Fе з розчину її солі?
ІV. Закріплення навчального матеріалу.
Будову і властивості речовин вивчають для того, щоб застосувати в техніці, побуті. Де застосовують залізо?
V. Узагальнення вивченого матеріалу.
Висловлювання думок, щодо застосування Fе.
Біологічна роль Fе в природі. Доповідь учнів.
Організм дорослої людини містить приблизно 4-5 г Fе, з яких 57 % входять до складу гемоглобіну. Добова потреба для дорослої людини становить близько 15 мг, для дитини — 7 мг. Fе бере участь в утворенні гемоглобіну, який транспортує кисень, дихальних ферментів, міоглобіну, який запасає кисень у зв'язаному вигляді в м'язах, бере участь у побудові ядра клітини. Більша частина Fе міститься в печінці та селезінці, а також у кістковому мозку.
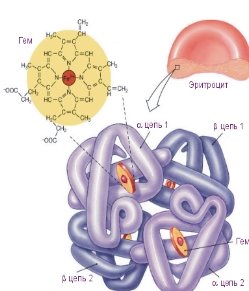 Залізо необхідно рослинам для утворення гемоглобіну. В організмі людини, як і в організмі тварин, залізо присутнє в усіх тканинах, але найбільше його міститься (близько 3 г) у кров'яних клітинах. Наприкінці XIX століття німецький фізіолог Густав Бунге сказав, що «залізо слід купляти не в аптеці, а на базарі, і в першу чергу яйцях та шпинаті». З м'ясної їжі засвоюється лише 20 % Fе, а з рослинної — 6 %.
Залізо необхідно рослинам для утворення гемоглобіну. В організмі людини, як і в організмі тварин, залізо присутнє в усіх тканинах, але найбільше його міститься (близько 3 г) у кров'яних клітинах. Наприкінці XIX століття німецький фізіолог Густав Бунге сказав, що «залізо слід купляти не в аптеці, а на базарі, і в першу чергу яйцях та шпинаті». З м'ясної їжі засвоюється лише 20 % Fе, а з рослинної — 6 %.
За нестачі Ре в людському організмі розвивається недокрів'я (анемія). Це захворювання було відоме ще в XVIІ ст. У деяких європейських країнах у разі недокрів'я прописували настій залізних ошурок у червоному вині.
Природа недокрів'я:
- зменшення кількості еритроцитів;
- зниження вмісту гемоглобіну.
Чинники, що викликають недокрів'я:
(Можна провести роботу з підручником.)
- Недостатнє харчування.
- Нестача вітамінів.
- Руйнування еритроцитів алкоголем.
- Вплив промислових викидів, що містять бензен і солі важких металів.
- Радіаційне забруднення довкілля.
Види запобігання недокрів'ю:
- медикаментозне лікування;
- переливання крові;
- посилене харчування;
- правильний режим праці й відпочинку.
Для профілактики анемії корисно їсти яблука, салат, шпинат, гречку, яйця, буряки, печінку, яловичину, виноград.
Але надлишок в організмі Fе також шкідливий. При цьому відбувається відкладання сполук Fе в тканинах ока та легенях і розвивається таке захворювання, як сидероз очей і легень. Вдихання пилу, що містить сполуки Fе, зумовлює зміни у складі крові, спричиняє стоматит, гастрит.
в)Оцінювально - рефлексивний етап.(10хв)
1.Робота з тестами.
1. Який максимальний ступінь окиснення Феруму в сполуках:
 А) +6; б)+7;в)+3;г)+5.(+3)
А) +6; б)+7;в)+3;г)+5.(+3)
2) Назвіть формулу червоного залізняку:
А) Fe2O3; б )Fe3O4;в) FeS2; г) FeCO3.(а)
3) Яку хворобу спричиняє нестача Fe в організмі:
А) лейкемія; б ) лімфома;в) анемію; г) тромбоцитопенія.(в)
4) В яких органах найбільший вміст Феруму?
А) печінка; б ) серце;в) легені; г) нирки.(в);
5) Ферум – це:
А) s-елемент; б )p-елемент; в)d-елемент; г) f-елемент. (д)
6) 2) Назвіть формулу магнітного залізняку:
А) Fe2O3; б ) Fe3O4; в) FeS2; г) FeCO3.(а)
2.Висновки по уроку.
Отже повернемось на якусь мить до початку уроку і з’ясуємо: «Чому ж ми вивчаємо тільки Fе?»
3.Оцінювання знання
4.Домашнє завдання: параграф № 37, стр. 55, 57-58
Використані джерела
- Методика викладання шкільного курсу хімії: Посібник для вчителя/ Н.М.
Ярошенко О.Г. Групова навчальна діяльність школярів: теорія і методика: (На матеріалі вивчення хімії). - К.: Партнёр, 1997. - 208с.
- Ярошенко О.Г., Коршак Т. Є. Перевір, як ти знаєш неорганічну хімію: Збірник тестів і тестових завдань для 8-10 кл. - К.: Курс, 1998. - 64с.
- О.Г.Ярошенко, Хімія: Підручник для 10 класів загальноосвітніх навчальних закладів, К.: «Грамота», 2010, §22


про публікацію авторської розробки
Додати розробку
