Гальванічний елемет в природі: овочі і фрукти
Про матеріал
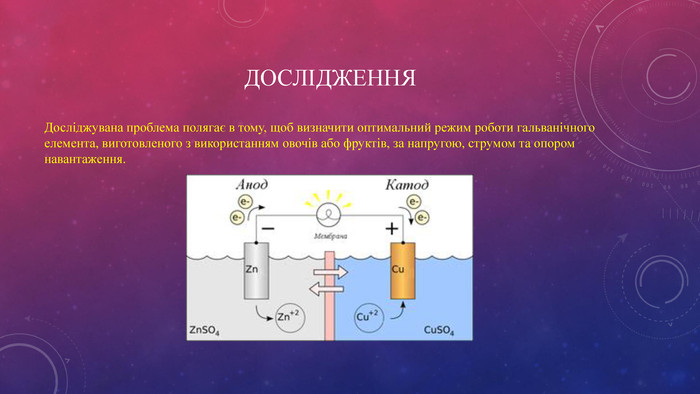
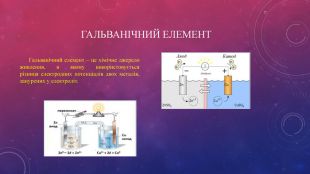
Гальвані́чний елеме́нт — хімічне джерело живлення, в якому використовується різниця електродних потенціалів двох металів, занурених у електроліт. Гальванічний елемент є непідзарядним хімічним джерелом електроенергії. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку