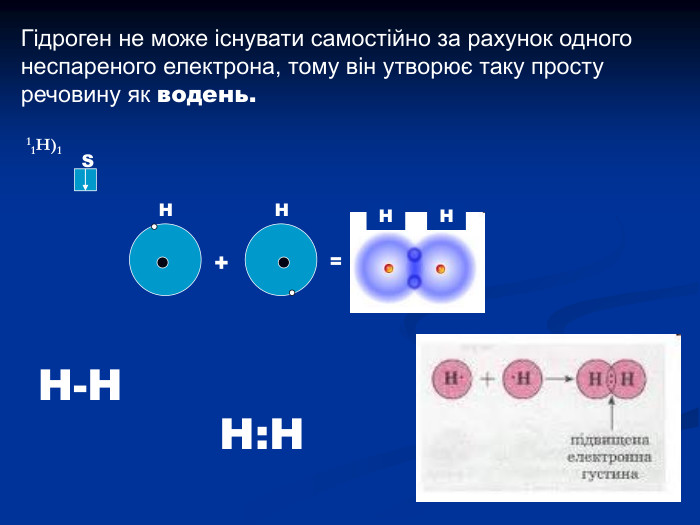
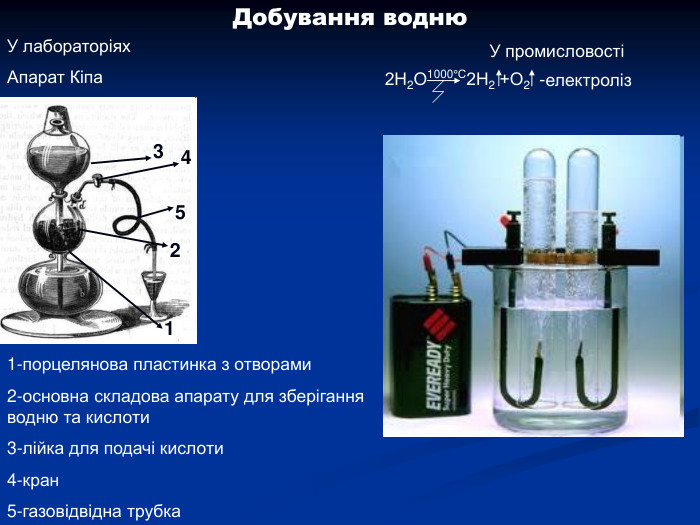
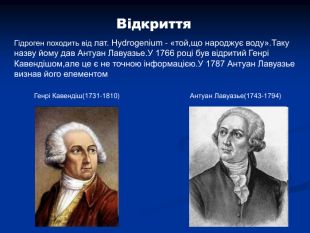
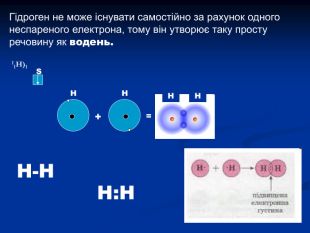
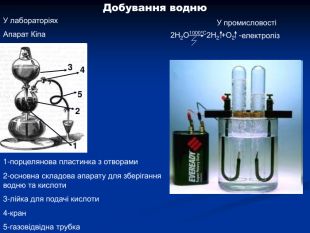
Гідроген. Водень. Історичний аспект, положення в ПС, поширення, будова, властивості, добування.
Про матеріал
Гідроген. Водень. Історичний аспект, положення в ПС, поширення, будова, властивості, добування. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку