Гідроліз солей у водному середовищі
Про матеріал
Данна робота розглядеє коротко і схематично процес гідролізу солей у водних середовищах на основі роботи також є відео у youtube: https://youtu.be/Ccnvus-4TKk?si=4cvQJ2nhQb0oeBfN Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



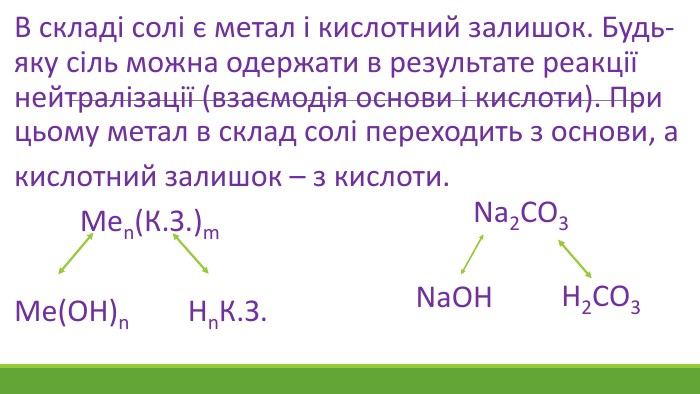

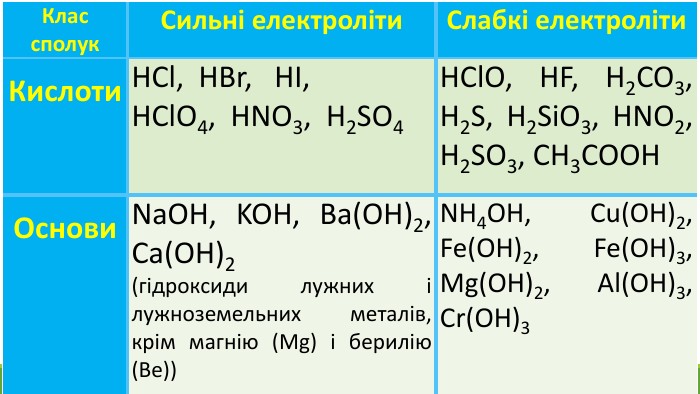


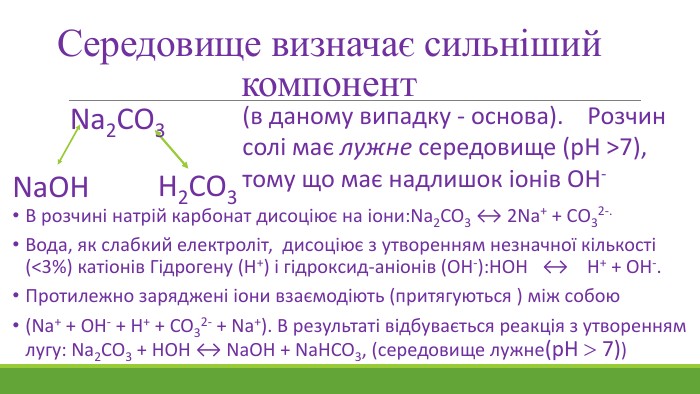
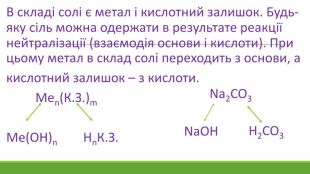
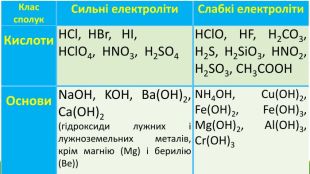
![Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони:2 Na+ + CО32- + НОН ↔ Na+ + ОН- + Na+ + НCO3- Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: CО32- + НОН ↔ ОН- + НCO3- , р. Н>7 [Н+]<[ОН-]Під час гідролізу іони Н+ з’єднуються з карбонат-іонами в слабкий електроліт Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони:2 Na+ + CО32- + НОН ↔ Na+ + ОН- + Na+ + НCO3- Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: CО32- + НОН ↔ ОН- + НCO3- , р. Н>7 [Н+]<[ОН-]Під час гідролізу іони Н+ з’єднуються з карбонат-іонами в слабкий електроліт](/uploads/files/1153846/372274/427701_images/9.jpg)